
El experimento de evolución a largo plazo de E. coli ( LTEE ) es un estudio en curso sobre evolución experimental iniciado por Richard Lenski en la Universidad de California, Irvine , continuado por Lenski y sus colegas en la Universidad Estatal de Michigan , [2] y actualmente supervisado por Jeffrey Barrick en la Universidad de Texas en Austin . [3] Ha estado rastreando cambios genéticos en 12 poblaciones inicialmente idénticas de bacterias asexuales de Escherichia coli desde el 24 de febrero de 1988. [4] Lenski realizó la transferencia número 10,000 del experimento el 13 de marzo de 2017. [5] Las poblaciones alcanzaron más de 73,000 generaciones a principios de 2020, poco antes de ser congeladas debido a la pandemia de COVID-19 . [6] En septiembre de 2020, el experimento LTEE se reanudó utilizando las existencias congeladas. [7] Cuando las poblaciones alcanzaron las 75,000 generaciones, el LTEE se transfirió del laboratorio de Lenski al laboratorio de Barrick. [3] En agosto de 2024, las poblaciones LTEE superaron las 80.000 generaciones en el laboratorio de Barrick. [8]
A lo largo del experimento, Lenski y sus colegas han informado de una amplia gama de cambios fenotípicos y genotípicos en las poblaciones en evolución. Estos han incluido cambios que han ocurrido en las 12 poblaciones y otros que solo han aparecido en una o unas pocas poblaciones. Por ejemplo, las 12 poblaciones mostraron un patrón similar de rápida mejora en la aptitud que se desaceleró con el tiempo, tasas de crecimiento más rápidas y aumento del tamaño celular. La mitad de las poblaciones han desarrollado defectos en la reparación del ADN que han causado fenotipos mutadores marcados por tasas de mutación elevadas. La adaptación más notable informada hasta ahora es la evolución del crecimiento aeróbico en citrato , lo cual es inusual en E. coli , en una población en algún momento entre las generaciones 31.000 y 31.500. [9] [10] Sin embargo, E. coli generalmente crece en citrato en condiciones anaeróbicas y tiene un ciclo de ácido cítrico activo que puede metabolizar el citrato incluso en condiciones aeróbicas. [11] El evento aeróbico es principalmente una cuestión de que el citrato pueda entrar en la célula. [12] [11]
El 4 de mayo de 2020, Lenski anunció una renovación de 5 años de la subvención a través del Programa de Investigación a Largo Plazo en Biología Ambiental (LTREB) de la Fundación Nacional de Ciencias que apoya el LTEE. [13] También anunció que el Dr. Jeffrey Barrick, profesor asociado de Biociencias Moleculares en la Universidad de Texas en Austin, se haría cargo de la supervisión del experimento dentro del período de financiación de 5 años. [14] El tiempo del experimento en la Universidad Estatal de Michigan terminó en mayo de 2022, cuando las poblaciones alcanzaron las 75.000 generaciones, pero el experimento se revivió y reinició en el laboratorio de Barrick el 21 de junio de 2022. [3]
El experimento de evolución a largo plazo fue diseñado como un método abierto de examen empírico de las características centrales de la evolución . El experimento se inició con tres objetivos principales:
A medida que el experimento ha continuado, su alcance ha crecido a medida que han surgido nuevas preguntas en biología evolutiva que se pueden abordar con él, a medida que la evolución de las poblaciones ha presentado nuevos fenómenos para estudiar y a medida que la tecnología y las técnicas metodológicas han avanzado. [16]
El uso de E. coli como organismo experimental ha permitido estudiar muchas generaciones y grandes poblaciones en un período de tiempo relativamente corto. Además, debido al largo uso de E. coli como organismo modelo principal en biología molecular , una amplia gama de herramientas, protocolos y procedimientos estaban disponibles para estudiar cambios a nivel genético, fenotípico y fisiológico. [17] Las bacterias también se pueden congelar y conservar mientras permanecen viables. Esto ha permitido la creación de lo que Lenski describe como un "registro fósil congelado" de muestras de poblaciones en evolución que pueden revivir en cualquier momento. Este registro fósil congelado permite reiniciar las poblaciones en casos de contaminación u otra interrupción en el experimento, y permite el aislamiento y la comparación de ejemplares vivos de clones ancestrales y evolucionados. Lenski eligió una cepa de E. coli que se reproduce solo asexualmente , carece de plásmidos que puedan permitir la conjugación bacteriana y no tiene profagos viables . Como consecuencia, la evolución en el experimento ocurre solo por los procesos evolutivos centrales de mutación , deriva genética y selección natural . Esta estricta asexualidad también significa que los marcadores genéticos persisten en linajes y clados por descendencia común , pero no pueden propagarse de otra manera en las poblaciones. [15]
Lenski eligió llevar a cabo el experimento con las bacterias cultivadas en un medio limitado en glucosa llamado DM25, [18] que se basa en un medio mínimo desarrollado por Bernard Davis para su uso en el aislamiento de mutantes auxotróficos de E. coli utilizando penicilina como agente selectivo. [19] [20] Para hacer DM25, el medio mínimo se complementa con una concentración baja (25 mg/L) de glucosa. [18] Lenski eligió esta concentración para simplificar el análisis de la evolución de las poblaciones al reducir la interferencia clonal , en la que múltiples versiones de alelos compiten en una población en evolución, al tiempo que reduce la posibilidad de evolución de interacciones ecológicas. [15] Esta concentración de glucosa utilizada admite una población máxima de 500 millones de células del ancestro en un cultivo de 10 mL, aunque el máximo ahora varía entre las poblaciones evolucionadas. [19] DM25 también contiene una gran cantidad de citrato (aproximadamente 11 veces la concentración de glucosa), que fue incluido originalmente por Davis porque mejoraba la eficiencia letal de la penicilina durante sus experimentos, aunque ahora se sabe que ayuda a la E. coli a adquirir hierro del medio. [19] [21]
Las 12 poblaciones se mantienen en una incubadora a 37 °C (99 °F) en el laboratorio de Lenski en la Universidad Estatal de Michigan . Cada día, el 1% de cada población se transfiere a un matraz con medio de crecimiento DM25 fresco. La dilución significa que cada población experimenta 6,64 generaciones, o duplicaciones, cada día. Se congelan muestras grandes y representativas de cada población con glicerol como crioprotector a intervalos de 500 generaciones (75 días). Las bacterias en estas muestras permanecen viables y se pueden revivir en cualquier momento. Esta colección de muestras se conoce como el "registro fósil congelado" y proporciona un historial de la evolución de cada población a lo largo de todo el experimento. Las poblaciones también se examinan periódicamente para detectar cambios en la aptitud media y se realizan experimentos complementarios regularmente para estudiar desarrollos interesantes en las poblaciones. [22] A partir de abril de 2016 [actualizar], las poblaciones de E. coli han estado bajo estudio durante más de 64.500 generaciones, y se cree que han sufrido suficientes mutaciones espontáneas como para que cada posible mutación puntual en el genoma de E. coli haya ocurrido varias veces. [9]
La cepa de E. coli que Lenski eligió para su experimento de evolución a largo plazo se derivó de la "cepa B", como se describe en un artículo de 1966 de Seymour Lederberg (que identificó incorrectamente la cepa como "Bc251", aunque un análisis genético posterior descubrió que era "B"), a través de Bruce Levin, quien la había utilizado en un experimento de ecología bacteriana en 1972. Los rasgos genéticos definitorios de esta cepa fueron: T6 r , Str r , r − m − , Ara − (incapaz de crecer en arabinosa ). [4] Lenski designó la cepa fundadora original como REL606. Antes del comienzo del experimento, Lenski aisló una variante Ara + de la cepa en la que una mutación puntual en el operón ara había restaurado el crecimiento en arabinosa, que designó como cepa REL607. Al comenzar el experimento de evolución a largo plazo, Lenski fundó seis poblaciones con seis colonias individuales Ara − de REL606. Estas poblaciones se conocen como Ara-1 a Ara-6. Lenski también encontró seis poblaciones más a partir de seis colonias individuales Ara + de REL607. Estas se conocen como poblaciones Ara+1 a Ara+6. Las diferencias en los marcadores permiten diferenciar las cepas en placas de arabinosa de tetrazolio, en las que las colonias Ara − aparecen en rojo, mientras que las colonias Ara + aparecen en blanco o rosa. A lo largo del experimento, cada población ha acumulado una gran cantidad de mutaciones distintas, lo que permite otros medios para identificar cepas por su población de origen. [ cita requerida ]
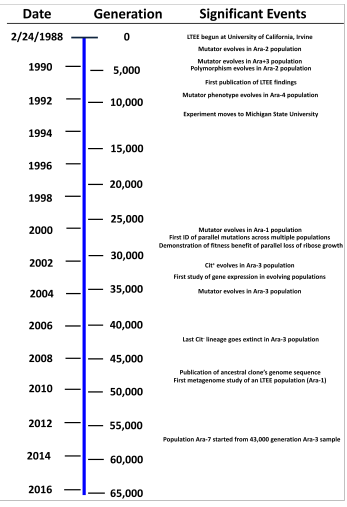
Gran parte del análisis del experimento se ha centrado en cómo ha cambiado la aptitud de las poblaciones en relación con su cepa ancestral. Todas las poblaciones mostraron un patrón de rápido aumento de la aptitud relativa durante las primeras generaciones, con este aumento desacelerándose con el tiempo. A las 20.000 generaciones, las poblaciones crecieron aproximadamente un 70% más rápido que la cepa ancestral. [15] Este aumento y desaceleración del aumento ha continuado en las generaciones posteriores. Un estudio de 2013 realizado por Wiser et al. informó de una mejora continua a las 50.000 generaciones en relación con las muestras aisladas a las 40.000 generaciones. Encontraron que el aumento de la aptitud se ajustaba a un modelo de ley de potencia mucho mejor que los modelos hiperbólicos que se habían utilizado anteriormente. Como un modelo de ley de potencia describe un aumento cada vez más lento que no tiene límite superior, mientras que un modelo hiperbólico implica un límite estricto, el trabajo sugirió que el aumento continuaría sin límite a medida que se fijaran mutaciones de beneficio progresivamente menor en las poblaciones. [24] Un trabajo posterior publicado en 2015 informó los resultados de más de 1100 nuevos ensayos de aptitud que examinaron los cambios de aptitud a lo largo de 60.000 generaciones. Los datos una vez más se ajustan al modelo de ley de potencia propuesto y, de hecho, se ajustan a las predicciones del modelo a partir de datos anteriores. Estos resultados sugieren que, contrariamente a lo que se pensaba anteriormente, la adaptación y la divergencia adaptativa pueden aumentar potencialmente de forma indefinida, incluso en un entorno constante. [25] [26] [27]
De las 12 poblaciones, hasta ahora se ha informado que seis han desarrollado defectos en su capacidad para reparar el ADN , lo que aumenta en gran medida la tasa de mutación en esas cepas. [10] [28] [29] Aunque se cree que las bacterias en cada población han generado cientos de millones de mutaciones durante las primeras 20.000 generaciones, Lenski ha estimado que dentro de este período de tiempo, solo de 10 a 20 mutaciones beneficiosas lograron la fijación en cada población, con menos de 100 mutaciones puntuales totales (incluidas las mutaciones neutrales ) que alcanzaron la fijación en cada población. [15] En 2009, Barrick et al. informaron los resultados de las secuencias del genoma de múltiples puntos temporales en la población Ara-1. Encontraron que, a diferencia de la tasa decreciente de mejora de la aptitud, la acumulación de mutaciones era lineal y similar a un reloj, aunque varias líneas de evidencia sugerían que gran parte de la acumulación era beneficiosa, en lugar de neutral. [30]
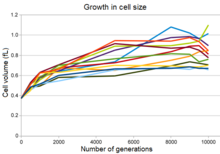
Las doce poblaciones experimentales muestran un aumento del tamaño celular concurrente con una disminución de la densidad máxima de población y, en muchas de las poblaciones, una forma celular más redondeada. Este cambio fue en parte el resultado de una mutación que modificó la expresión de un gen de una proteína que se une a la penicilina , lo que permitió que las bacterias mutantes superaran a las bacterias ancestrales en las condiciones del experimento de evolución a largo plazo. Sin embargo, aunque esta mutación aumentó la aptitud en estas condiciones, también aumentó la sensibilidad de las bacterias al estrés osmótico y disminuyó su capacidad para sobrevivir largos períodos en cultivos en fase estacionaria. [31]
A lo largo del experimento, las poblaciones han evolucionado para especializarse en el recurso de glucosa en el que crecen. Esto se describió por primera vez en 2000, cuando Cooper y Lenski demostraron que todas las poblaciones habían experimentado una decadencia de funciones metabólicas no utilizadas después de 20.000 generaciones, lo que restringió el rango de sustancias en las que las bacterias podían crecer. Su análisis sugirió que esta decadencia se debía a la pleiotropía antagónica , en la que las mutaciones que mejoraron la capacidad de crecer en glucosa habían reducido o eliminado la capacidad de crecer en otras sustancias. [32] Un estudio posterior de Leiby y Marx que utilizó técnicas más avanzadas mostró que gran parte de la decadencia que Cooper y Lenski habían identificado eran artefactos experimentales, que la pérdida de funciones no utilizadas no era tan extensa como se pensó inicialmente y que algunas funciones no utilizadas habían mejorado. Además, concluyeron que las pérdidas metabólicas no se debían a la pleiotropía antagónica, sino a la acumulación neutral de mutaciones en porciones no utilizadas del genoma, lo que sugiere que la adaptación a un entorno simple podría no conducir necesariamente a la especialización. [33]
Se identificaron dos variantes distintas, S y L, en la población denominada Ara-2 a las 18.000 generaciones, basándose en su formación de colonias pequeñas y grandes, respectivamente. Los clones de los tipos S y L podían coexistir de forma estable en cocultivo entre sí, lo que indica que ocupaban nichos distintos en la población. Esto se verificó mediante el hallazgo de que el tipo L tenía una ventaja durante el crecimiento en glucosa, pero que S tenía una ventaja durante la fase estacionaria, después de que la glucosa se había agotado. Se descubrió que los dos tipos habían evolucionado inicialmente antes de las 6.000 generaciones, y luego coexistieron a partir de entonces. [34] El análisis filogenético de los clones de los dos tipos aislados de diferentes generaciones demostró que los tipos S y L pertenecían a linajes distintos y coexistentes en la población, y podrían estar experimentando una especiación incipiente. [35]
El nacimiento de genes de novo es el proceso por el cual surgen nuevos genes por mutaciones que impactan en tramos de ADN previamente no codificante . Sin embargo, generalmente es difícil observar casos de nacimiento de genes. [36] Al analizar la gran colección de secuencias de genoma completo de clones de E. coli muestreados de las poblaciones LTEE, [37] un estudio de 2024 descubrió varios casos posibles de nacimiento de genes que involucraron la generación de nuevastranscripciones de ARNm y proteínas asociadas con mutaciones cercanas. [38] Los roles funcionales, si los hay, de estos nuevos protogenes siguen siendo desconocidos.

E. coli normalmente no puede crecer aeróbicamente en citrato debido a la incapacidad de expresar un transportador de citrato cuando hay oxígeno presente. [11] Sin embargo, E. coli tiene un ciclo de ácido cítrico completo y, por lo tanto, metaboliza citrato como intermediario durante el crecimiento aeróbico en otras sustancias, incluida la glucosa. La mayoría de E. coli puede crecer anaeróbicamente en citrato a través de la fermentación , si un cosustrato como la glucosa está disponible para proporcionar poder reductor. [9] [11] [40] [41] El crecimiento anaeróbico es posible debido a la expresión de un gen antiportador de citrato-succinato transmembrana, citT , que se identificó por primera vez en 1998. Este gen está co-regulado con otros genes involucrados en la fermentación de citrato que se encuentran en el operón cit , que se activa solo cuando el oxígeno está ausente. [11] [42]
La incapacidad de crecer aeróbicamente en citrato, conocida como fenotipo Cit − , se considera una característica definitoria de E. coli como especie, y una que ha sido un medio valioso para diferenciar E. coli de Salmonella patógena . Aunque se han aislado cepas Cit + de E. coli de muestras ambientales y agrícolas, en cada uno de esos casos, se encontró que el rasgo se debía a la presencia de un plásmido que transporta un transportador de citrato extraño. [12] Hall informó de un único mutante Cit + espontáneo de E. coli en 1982. Este mutante había sido aislado durante una selección prolongada para el crecimiento en otra sustancia nueva en un caldo de crecimiento que también contenía citrato. El análisis genético de Hall indicó que la mutación subyacente era compleja, pero en última instancia no pudo identificar los cambios precisos o los genes involucrados, lo que lo llevó a plantear la hipótesis de la activación de un gen transportador críptico. [43] Las regiones del genoma a las que Hall pudo limitar las ubicaciones de los cambios no corresponden a la ubicación conocida del gen citT identificado 16 años después, ni las características fisiológicas en los ensayos de transporte de los mutantes Cit + de Hall coinciden con las esperadas para la expresión aeróbica del transportador CitT. [12] [44]
En 2008, el equipo de Lenski, dirigido por Zachary D. Blount , informó que la capacidad de crecer aeróbicamente en citrato había evolucionado en una población. Alrededor de la generación 33.127, se observó un aumento dramático en la turbidez en la población denominada Ara-3. Encontraron que la población contenía clones que podían crecer aeróbicamente en citrato (Cit + ). Esta capacidad metabólica permitió que la población creciera varias veces más de lo que había crecido anteriormente, debido a la gran cantidad de citrato presente en el medio. El examen de muestras fósiles congeladas de las poblaciones mostró que los clones Cit + podían aislarse ya en 31.500 generaciones. Se encontró que las variantes Cit + en la población poseían una serie de marcadores genéticos exclusivos de la población Ara-3; esta observación excluyó la posibilidad de que los clones fueran contaminantes, en lugar de mutantes espontáneos. En una serie de experimentos que "repetían" la evolución de Ara-3 a partir de clones Cit − aislados de muestras congeladas en varios puntos temporales de la historia de la población, demostraron que la capacidad de crecer aeróbicamente con citrato tenía más probabilidades de volver a evolucionar en un subconjunto de clones genéticamente puros y evolucionados. En estos experimentos, observaron 19 casos nuevos e independientes de reevolución de Cit + , pero solo cuando se partía de clones aislados después de la generación 20.000. Las pruebas de fluctuación mostraron que los clones de esta generación y posteriores mostraban una tasa de mutación del rasgo Cit + que era significativamente mayor que la tasa ancestral. Incluso en estos clones posteriores, la tasa de mutación de Cit + era del orden de una ocurrencia por billón de divisiones celulares. [9]
Lenski y sus colegas concluyeron que la evolución de la función Cit + en esta población surgió debido a una o más mutaciones "potenciadoras" anteriores, posiblemente no adaptativas, que aumentaron la tasa de mutación a un nivel accesible. Los datos sugirieron que el uso de citrato implicó al menos dos mutaciones posteriores a estas mutaciones "potenciadoras". De manera más general, los autores sugieren que estos resultados indican, siguiendo el argumento de Stephen Jay Gould , "que la contingencia histórica puede tener un impacto profundo y duradero" en el curso de la evolución. [9] Estos hallazgos han llegado a considerarse un ejemplo significativo del impacto de la contingencia histórica en la evolución . [19] [45] [46]
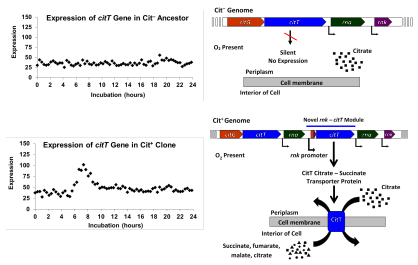
En 2012, Lenski y su equipo informaron los resultados de un análisis genómico del rasgo Cit + que arrojó luz sobre la base genética y la historia evolutiva del rasgo. Los investigadores habían secuenciado los genomas completos de veintinueve clones aislados de varios puntos temporales en la historia de la población Ara-3. Utilizaron estas secuencias para reconstruir la historia filogenética de la población; esta reconstrucción mostró que la población se había diversificado en tres clados en 20.000 generaciones. Las variantes Cit + habían evolucionado en uno de ellos, al que llamaron clado 3. Los clones que se habían encontrado potenciados en investigaciones anteriores se distribuyeron entre los tres clados, pero estaban sobrerrepresentados en el clado 3. Esto llevó a los investigadores a concluir que había habido al menos dos mutaciones potenciadoras implicadas en la evolución de Cit + . [10]
Los investigadores también descubrieron que todos los clones Cit + tenían mutaciones en las que se duplicaba o amplificaba un segmento de ADN de 2933 pares de bases. El segmento duplicado contenía el gen citT para la proteína transportadora de citrato utilizada en el crecimiento anaeróbico en citrato. La duplicación es en tándem y dio como resultado copias que estaban de cabeza a cola entre sí. Esta nueva configuración colocó una copia del citT previamente silencioso y no expresado bajo el control del promotor del gen rnk adyacente, que dirige la expresión cuando hay oxígeno presente. Este nuevo módulo rnk-citT produjo un nuevo patrón regulador para citT , activando la expresión del transportador de citrato cuando había oxígeno presente y, por lo tanto, permitió el crecimiento aeróbico en citrato. [10]
Se demostró que el movimiento de este módulo rnk-citT en el genoma de un clon potenciado de Cit − era suficiente para producir un fenotipo Cit + . Sin embargo, el fenotipo Cit + inicial conferido por la duplicación era muy débil y solo otorgaba un beneficio de adaptación de aproximadamente el 1 %. Los investigadores descubrieron que era necesario aumentar la cantidad de copias del módulo rnk-citT para fortalecer el rasgo Cit + lo suficiente como para permitir que las bacterias crecieran bien en el citrato. Otras mutaciones posteriores a que las bacterias Cit + se volvieran dominantes en la población continuaron acumulando un crecimiento mejorado en el citrato. [ cita requerida ]
Los investigadores concluyeron que la evolución del rasgo Cit + se produjo en tres fases distintas: (1) se acumularon mutaciones que aumentaron la tasa de mutación a Cit + , (2) el rasgo en sí apareció en una forma débil y (3) el rasgo fue mejorado por mutaciones posteriores. Blount et al. sugirieron que este patrón podría ser típico de cómo evolucionan los rasgos nuevos en general y propusieron un modelo de innovación evolutiva en tres etapas:
Este modelo ha tenido aceptación en la biología evolutiva. En 2015, el paleontólogo Douglas Erwin sugirió una modificación de un modelo de cuatro pasos para reflejar mejor una posible distinción entre novedad e innovación evolutiva y para destacar la importancia de las condiciones ambientales: potenciación, generación de fenotipos nuevos (actualización), refinamiento adaptativo y explotación (conversión de una novedad en una innovación a medida que se vuelve importante para el establecimiento ecológico de los organismos que la poseen). [48]
En 2014, un equipo de investigación dirigido por Eric Quandt en el laboratorio de Jeffrey Barrick en la Universidad de Texas en Austin describió la aplicación de una nueva técnica llamada Recombinación y secuenciación recursiva del genoma (REGRES) para identificar mutaciones potenciadoras entre las 70 presentes en el linaje Ara-3 que evolucionaron Cit + . [49] Este método utilizó múltiples rondas de un proceso en el que la conjugación basada en el plásmido F entre un clon Cit + de 33.000 generaciones , CZB154, y el clon fundador Cit − del LTEE para purgar las mutaciones no requeridas para la manifestación de una forma débil o fuerte del rasgo Cit + , este último denominado Cit ++ . Encontraron que el módulo rnk-citT responsable del cambio fenotípico a Cit + era suficiente para producir un fenotipo Cit + débil en el ancestro. También identificaron una mutación que se había producido en el linaje que conduce a CZB154 después de la evolución inicial de Cit + que confirió un fenotipo fuerte, Cit ++ en el ancestro ausente de cualquier mutación excepto el módulo rnk-citT . Esta mutación, encontrada en la región reguladora de un gen llamado dctA , causó un aumento masivo en la expresión del transportador DctA , que funciona para importar C 4 -dicarboxilatos en la célula. Esta expresión aumentada de DctA, descubrieron, permitió a las células Cit + recaptar succinato , malato y fumarato liberados en el medio por el transportador CitT durante la importación de citrato. Identificaron una mutación similar en clones Cit ++ en la población Ara-3 que aumentó la expresión de DctA al restaurar la función de un gen que lo regula, dcuS , que había sido desactivado en el clon ancestral. Quandt et al. concluyeron que la mutación dctA no estaba involucrada en la potenciación, sino en el refinamiento. Esto los llevó a sugerir que la evolución de Cit + en la población Ara-3 podría haber dependido de un trasfondo genético y una ecología específica de la población que permitió que las variantes tempranas y débiles de Cit + persistieran en la población el tiempo suficiente para que surgieran mutaciones de refinamiento y volvieran el crecimiento en citrato lo suficientemente fuerte como para proporcionar un beneficio de aptitud significativo. [ cita requerida ]
Quandt y sus colegas publicaron posteriormente hallazgos que identificaban definitivamente una mutación que sí potenciaba la evolución de Cit + . [50] Esta mutación estaba en el gen gltA , que codifica la citrato sintasa , una enzima implicada en el flujo de carbono hacia el ciclo del ácido cítrico . Tuvo el efecto de aumentar la actividad de la citrato sintasa, y demostraron que permitía un mejor crecimiento en acetato . Además, con la mutación gltA , el módulo rnk-citT que causa el rasgo Cit + tiene un efecto de aptitud de neutro a ligeramente beneficioso, mientras que, sin él, el módulo era fuertemente perjudicial. Por lo tanto, la mutación gltA parece haber permitido que las variantes tempranas y débiles de Cit + persistieran en la población hasta que pudieran ocurrir mutaciones de refinamiento posteriores, en consonancia con sus conclusiones anteriores. Después de que evolucionara un fenotipo fuerte de Cit ++ , la mayor actividad de la citrato sintasa se volvió perjudicial. Los investigadores descubrieron que las mutaciones posteriores en gltA contrarrestaron la primera mutación, reduciendo la actividad de la citrato sintasa y mejorando aún más el crecimiento en citrato. Llegaron a la conclusión de que la serie de mutaciones en gltA primero potenció y luego refinó el crecimiento en citrato. También sugirieron que el linaje en el que surgió Cit + podría haber ocupado un nicho en Ara-3 basado en el crecimiento en acetato, y que las mutaciones potenciadoras que llevaron a la evolución de Cit + en Ara-3 fueron originalmente adaptativas para el uso de acetato. [ cita requerida ]
Una pequeña subpoblación de células Cit − incapaces de crecer en citrato y pertenecientes a un clado separado persistió en la población después de que las células Cit + se volvieran dominantes. Los primeros hallazgos mostraron que esta diversidad se debía en parte a que las células Cit − eran mejores para crecer en la glucosa del medio. [9] Turner et al. descubrieron más tarde que otro factor detrás de la coexistencia era que las células Cit − desarrollaron la capacidad de alimentarse de forma cruzada con la mayoría Cit + . Demostraron que las células Cit + liberan succinato , malato y fumarato durante el crecimiento en citrato, ya que el transportador CitT bombea estas sustancias fuera de la célula mientras bombea citrato dentro de la célula. Las células Cit − habían desarrollado rápidamente la capacidad de crecer en estas sustancias debido a una mutación que restauró la expresión de una proteína transportadora apropiada que estaba silenciada en el ancestro. [51]
La subpoblación Cit − finalmente se extinguió en la población entre 43.500 y 44.000 generaciones. Se demostró que esta extinción no se debió a que la mayoría Cit + evolucionara para poder invadir el nicho ocupado por la minoría Cit − . De hecho, los clones Cit − podían invadir poblaciones Cit + después del evento de extinción. Además, en un experimento en el que reiniciaron veinte réplicas de la población Ara-3 de la muestra congelada 500 generaciones antes de la extinción, Turner et al. descubrieron que la subpoblación Cit − no se había extinguido en ninguna de las réplicas después de 500 generaciones de evolución. Una de estas réplicas se mantuvo durante 2.500 generaciones, durante las cuales Cit − continuó coexistiendo. Los investigadores concluyeron que la extinción de Cit − se había debido a alguna "perturbación ambiental rara" desconocida, similar a la que puede afectar a las poblaciones naturales. [52] La réplica final se integró en el experimento principal LTEE, convirtiéndose en la decimotercera población, Ara-7. [53]
Barry Hall ya había aislado una cepa mutante de E. coli aeróbica que utilizaba citrato en 1982 y la atribuyó a dos mutaciones en los genes citA y citB, que están vinculados al operón gal. [54] Algunos han contrastado los hallazgos de Hall como una "selección directa" no intencionada para mutantes Cit+ y los hallazgos de Lenski como una "pantalla" genética no intencionada para mutantes Cit+. [55] Otros investigadores han experimentado con la evolución de E. coli aeróbica que utilizaba citrato . Dustin Van Hofwegen et al. pudieron aislar 46 mutantes independientes de E. coli que utilizaban citrato en solo 12 a 100 generaciones utilizando una selección altamente prolongada bajo inanición, durante la cual las bacterias muestrearían más mutaciones más rápidamente. [55] En su investigación, la secuenciación del ADN genómico reveló una amplificación de los loci citT y dctA , y el reordenamiento del ADN eran la misma clase de mutaciones identificadas en el experimento de Richard Lenski y su equipo. Concluyeron que la rareza del mutante que utiliza citrato en la investigación de Lenski probablemente era resultado de las condiciones experimentales selectivas utilizadas por su equipo en lugar de ser un evento único de especiación evolutiva. [55]
John Roth y Sophie Maisnier-Patin revisaron los enfoques tanto de las mutaciones retardadas del equipo de Lenski como de las mutaciones rápidas del equipo de Van Hofwegen en E. coli . Argumentan que ambos equipos observaron la misma secuencia de potenciación, actualización y refinamiento que conduce a variantes similares de Cit + . [56] Según ellos, el período de Lenski de menos de un día durante el cual el uso de citrato estaría bajo selección, seguido de una dilución de 100 veces y un período de crecimiento en glucosa que no seleccionaría el uso de citrato; en última instancia, redujo la probabilidad de que E. coli pudiera acumular mutaciones adaptativas tempranas de un período de selección al siguiente. [56] Por el contrario, el equipo de Van Hofwegen permitió un período de selección continua de 7 días, lo que produjo un desarrollo más rápido de E. coli que usa citrato . Roth y Maisnier-Patin sugieren que la dilución en serie de E. coli y el corto período de selección para el uso de citrato en las condiciones de LTEE impidieron perpetuamente que cada generación de E. coli alcanzara las siguientes etapas de utilización aeróbica de citrato. [56]
Lenski sostiene que el problema no está en los experimentos ni en los datos, sino en las interpretaciones realizadas por Van Hofwegen et al. y Maisnier-Patin y Roth. [57] Según él, la rápida evolución de Cit + no fue necesariamente inesperada, ya que su equipo también pudo producir múltiples mutantes de Cit + en unas pocas semanas durante los experimentos de repetición. [58] Argumenta que el LTEE no fue diseñado para aislar mutantes que utilizan citrato ni para lidiar con la especiación, que es un proceso, no un evento. Además, argumentó que la evolución de Cit + en el LTEE dependía de mutaciones que se habían acumulado anteriormente. [58]