Una celda electroquímica es un dispositivo que genera energía eléctrica a partir de reacciones químicas . También se puede aplicar energía eléctrica a estas celdas para provocar que se produzcan reacciones químicas. [1] Las celdas electroquímicas que generan una corriente eléctrica se denominan celdas voltaicas o galvánicas y las que generan reacciones químicas, por ejemplo a través de la electrólisis , se denominan celdas electrolíticas . [2]
Se puede pensar que tanto las celdas galvánicas como las electrolíticas tienen dos semiceldas : cada una de las cuales consta de reacciones de oxidación y reducción separadas .
Cuando una o más celdas electroquímicas se conectan en paralelo o en serie forman una batería . Las celdas primarias son baterías de un solo uso.
Una celda galvánica (celda voltaica), llamada así en honor a Luigi Galvani ( Alessandro Volta ), es una celda electroquímica que genera energía eléctrica a partir de reacciones redox espontáneas. [3]

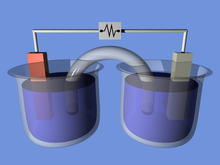
Un cable conecta dos metales diferentes (por ejemplo, zinc y cobre ). Cada metal se encuentra en una solución separada; a menudo, las formas acuosas de sulfato o nitrato del metal, aunque más generalmente son sales metálicas y agua que conducen la corriente . [4] Un puente salino o membrana porosa conecta las dos soluciones, manteniendo la neutralidad eléctrica y evitando la acumulación de carga. Las diferencias de potencial de oxidación/reducción de los metales impulsan la reacción hasta el equilibrio . [1]
Características principales:
Las celdas galvánicas constan de dos semiceldas, cada una de las cuales consta de un electrodo y un electrolito (ambas semiceldas pueden utilizar el mismo electrolito o electrolitos diferentes).
Las reacciones químicas en la celda involucran el electrolito, los electrodos y/o una sustancia externa ( las celdas de combustible pueden usar gas hidrógeno como reactivo ). En una celda electroquímica completa, las especies de una semicelda pierden electrones ( oxidación ) hacia su electrodo, mientras que las especies de la otra semicelda ganan electrones ( reducción ) de su electrodo.
Se utiliza un puente salino (por ejemplo, papel de filtro empapado en KNO3 , NaCl o algún otro electrolito) para conectar iónicamente dos semiceldas con diferentes electrolitos, pero evita que las soluciones se mezclen y se produzcan reacciones secundarias no deseadas. Una alternativa a un puente salino es permitir el contacto directo (y la mezcla) entre las dos semiceldas, por ejemplo, en la electrólisis simple del agua .
A medida que los electrones fluyen de una semicelda a la otra a través de un circuito externo , se establece una diferencia de carga. Si no se proporcionara contacto iónico, esta diferencia de carga evitaría rápidamente el flujo adicional de electrones. Un puente salino permite el flujo de iones negativos o positivos para mantener una distribución de carga en estado estable entre los recipientes de oxidación y reducción, mientras se mantienen separados los contenidos. Otros dispositivos para lograr la separación de soluciones son los recipientes porosos y las soluciones gelificadas. Un recipiente poroso se utiliza en la celda Bunsen .
Cada semicelda tiene un voltaje característico (dependiendo del metal y su potencial de reducción característico). Cada reacción está experimentando una reacción de equilibrio entre diferentes estados de oxidación de los iones: cuando se alcanza el equilibrio, la celda no puede proporcionar más voltaje . En la semicelda que realiza la oxidación, cuanto más cerca esté el equilibrio del ion/átomo con el estado de oxidación más positivo, más potencial proporcionará esta reacción. [1] Del mismo modo, en la reacción de reducción, cuanto más cerca esté el equilibrio del ion/átomo con el estado de oxidación más negativo , mayor será el potencial.
El potencial de la celda se puede predecir mediante el uso de potenciales de electrodo (los voltajes de cada semicelda). Estos potenciales de semicelda se definen en relación con la asignación de 0 voltios al electrodo de hidrógeno estándar (SHE). (Véase la tabla de potenciales de electrodo estándar ). La diferencia de voltaje entre los potenciales de electrodo proporciona una predicción del potencial medido. Al calcular la diferencia de voltaje, primero se deben reescribir las ecuaciones de reacción de la semicelda para obtener una ecuación de oxidación-reducción equilibrada.
Los potenciales de celda tienen un rango posible de aproximadamente cero a 6 voltios. Las celdas que utilizan electrolitos a base de agua suelen estar limitadas a potenciales de celda inferiores a unos 2,5 voltios debido a la alta reactividad de los potentes agentes oxidantes y reductores con el agua, que es necesaria para producir un voltaje más alto. Es posible alcanzar potenciales de celda más altos con celdas que utilizan otros disolventes en lugar de agua. Por ejemplo, las celdas de litio con un voltaje de 3 voltios están comúnmente disponibles.
El potencial de la celda depende de la concentración de los reactivos, así como de su tipo. A medida que se descarga la celda, la concentración de los reactivos disminuye y el potencial de la celda también disminuye.
Una celda electrolítica es una celda electroquímica en la que la energía eléctrica aplicada impulsa una reacción redox no espontánea . [5]

A menudo se utilizan para descomponer compuestos químicos, en un proceso llamado electrólisis . (La palabra griega "lisis" (λύσις) significa "soltar" o "liberar").
Ejemplos importantes de electrólisis son la descomposición del agua en hidrógeno y oxígeno , y de la bauxita en aluminio y otros productos químicos. La galvanoplastia (por ejemplo, de cobre, plata , níquel o cromo ) se realiza utilizando una celda electrolítica. La electrólisis es una técnica que utiliza una corriente eléctrica continua (CC).
Los componentes de una celda electrolítica son:
Cuando se aplica una tensión externa (diferencia de potencial) a los electrodos, los iones del electrolito son atraídos hacia el electrodo con el potencial opuesto, donde pueden tener lugar reacciones de transferencia de carga (también llamadas reacciones faradaicas o redox). Solo con una tensión externa suficiente, una celda electrolítica puede descomponer un compuesto químico normalmente estable o inerte en la solución. De este modo, la energía eléctrica proporcionada produce una reacción química que de otro modo no se produciría de forma espontánea.
Características principales:

Una celda primaria produce corriente mediante reacciones químicas irreversibles (por ejemplo, pequeñas baterías desechables) y no es recargable.
Se utilizan por su portabilidad, bajo coste y corta vida útil.
Las celdas primarias se fabrican en una variedad de tamaños estándar para alimentar pequeños electrodomésticos, como linternas y radios portátiles.
A medida que se producen reacciones químicas en una celda primaria, la batería consume las sustancias químicas que generan la energía; cuando se agotan, la batería deja de producir electricidad.
.jpg/440px-Diagram_of_a_primary_cell_(battery).jpg)
Las baterías primarias representan alrededor del 90% del mercado de baterías de $50 mil millones, pero las baterías secundarias han estado ganando participación de mercado. Alrededor de 15 mil millones de baterías primarias se desechan cada año en todo el mundo, [6] prácticamente todas terminan en vertederos. Debido a los metales pesados tóxicos y los ácidos o álcalis fuertes que contienen, las baterías son desechos peligrosos . La mayoría de los municipios los clasifican como tales y requieren su eliminación por separado. La energía necesaria para fabricar una batería es aproximadamente 50 veces mayor que la energía que contiene. [7] [8] [9] [10] Debido a su alto contenido de contaminantes en comparación con su pequeño contenido de energía, la batería primaria se considera una tecnología derrochadora y no respetuosa con el medio ambiente. Principalmente debido a las crecientes ventas de dispositivos inalámbricos y herramientas inalámbricas , que no pueden funcionar económicamente con baterías primarias y vienen con baterías recargables integradas, la industria de baterías secundarias tiene un alto crecimiento y lentamente ha estado reemplazando a la batería primaria en productos de alta gama.


Una celda secundaria produce corriente mediante reacciones químicas reversibles (por ejemplo, la batería de plomo-ácido de un automóvil) y es recargable .
Las baterías de plomo-ácido se utilizan en los automóviles para poner en marcha el motor y hacer funcionar los accesorios eléctricos del vehículo cuando el motor no está en marcha. El alternador, una vez que el vehículo está en marcha, recarga la batería.
Puede funcionar como celda galvánica y como celda electrolítica. Es una forma cómoda de almacenar electricidad: cuando la corriente fluye en un sentido, los niveles de uno o más químicos se acumulan (carga); mientras se descarga, se reducen y la fuerza electromotriz resultante puede realizar trabajo.
Se utilizan por su alto voltaje, bajos costos, confiabilidad y larga vida útil.

Una pila de combustible es una celda electroquímica que hace reaccionar el combustible de hidrógeno con oxígeno u otro agente oxidante para convertir la energía química en electricidad .
Las pilas de combustible se diferencian de las baterías en que requieren una fuente continua de combustible y oxígeno (normalmente del aire) para mantener la reacción química, mientras que en una batería la energía química proviene de sustancias químicas ya presentes en la batería.
Las pilas de combustible pueden producir electricidad de forma continua mientras se les suministre combustible y oxígeno .
Se utilizan como fuente de energía primaria y de reserva para edificios comerciales, industriales y residenciales y en áreas remotas o inaccesibles. También se utilizan para alimentar vehículos con celdas de combustible , incluidas carretillas elevadoras , automóviles, autobuses, barcos, motocicletas y submarinos.
Las pilas de combustible se clasifican por el tipo de electrolito que utilizan y por la diferencia en el tiempo de arranque, que varía desde 1 segundo para las pilas de combustible de membrana de intercambio de protones (pilas de combustible PEM o PEMFC) hasta 10 minutos para las pilas de combustible de óxido sólido (SOFC).
Hay muchos tipos de pilas de combustible, pero todas ellas constan de:
Una tecnología relacionada son las baterías de flujo , en las que el combustible se puede regenerar mediante recarga. Las celdas de combustible individuales producen potenciales eléctricos relativamente pequeños, alrededor de 0,7 voltios, por lo que las celdas se "apilan", o se colocan en serie, para crear suficiente voltaje para satisfacer los requisitos de una aplicación. [11] Además de electricidad, las celdas de combustible producen agua, calor y, dependiendo de la fuente de combustible, cantidades muy pequeñas de dióxido de nitrógeno y otras emisiones. La eficiencia energética de una celda de combustible generalmente está entre el 40 y el 60%; sin embargo, si se captura el calor residual en un esquema de cogeneración , se pueden obtener eficiencias de hasta el 85%.
Se estima que en 2022 el mercado mundial de pilas de combustible alcanzará los 6.300 millones de dólares y se espera que aumente un 19,9 % hasta 2030. [12] Muchos países están intentando entrar en el mercado estableciendo objetivos de GW de energía renovable . [13]
de una batería desechable requiere aproximadamente 50 veces más energía que la que la batería proporciona cuando se utiliza.