La teoría del campo de ligandos ( LFT ) describe el enlace, la disposición orbital y otras características de los complejos de coordinación . [1] [2] [3] [4] Representa una aplicación de la teoría de orbitales moleculares a los complejos de metales de transición . Un ion de metal de transición tiene nueve orbitales atómicos de valencia , que consisten en cinco orbitales n d, uno ( n +1)s y tres orbitales ( n +1)p. Estos orbitales tienen la energía adecuada para formar interacciones de enlace con ligandos . El análisis LFT depende en gran medida de la geometría del complejo, pero la mayoría de las explicaciones comienzan describiendo complejos octaédricos , donde seis ligandos se coordinan con el metal. Otros complejos se pueden describir con referencia a la teoría del campo cristalino . [5] La teoría del campo de ligando invertido (ILFT) profundiza en la LFT rompiendo los supuestos hechos sobre las energías orbitales relativas del metal y el ligando.
La teoría del campo de ligandos resultó de la combinación de los principios establecidos en la teoría de orbitales moleculares y la teoría del campo cristalino , que describen la pérdida de degeneración de los orbitales d de los metales en los complejos de metales de transición. John Stanley Griffith y Leslie Orgel [6] defendieron la teoría del campo de ligandos como una descripción más precisa de tales complejos, aunque la teoría se originó en la década de 1930 con el trabajo sobre magnetismo de John Hasbrouck Van Vleck . Griffith y Orgel utilizaron los principios electrostáticos establecidos en la teoría del campo cristalino para describir los iones de metales de transición en solución y utilizaron la teoría de orbitales moleculares para explicar las diferencias en las interacciones metal-ligando, explicando así observaciones como la estabilización del campo cristalino y los espectros visibles de los complejos de metales de transición. En su artículo, propusieron que la causa principal de las diferencias de color en los complejos de metales de transición en solución son las subcapas orbitales d incompletas. [6] Es decir, los orbitales d desocupados de los metales de transición participan en el enlace, lo que influye en los colores que absorben en solución. En la teoría del campo de ligandos, los diversos orbitales d se ven afectados de manera diferente cuando están rodeados por un campo de ligandos vecinos y su energía aumenta o disminuye según la fuerza de su interacción con los ligandos. [6]
En un complejo octaédrico, los orbitales moleculares creados por coordinación pueden verse como el resultado de la donación de dos electrones por cada uno de los seis ligandos σ-donadores a los orbitales d del metal . En los complejos octaédricos, los ligandos se aproximan a lo largo de los ejes x , y y z , por lo que sus orbitales de simetría σ forman combinaciones de enlace y antienlace con los orbitales d z 2 y d x 2 − y 2 . Los orbitales d xy , d xz y d yz siguen siendo orbitales no enlazantes. También ocurren algunas interacciones de enlace (y antienlace) débiles con los orbitales s y p del metal, para hacer un total de 6 orbitales moleculares de enlace (y 6 de antienlace) [7]
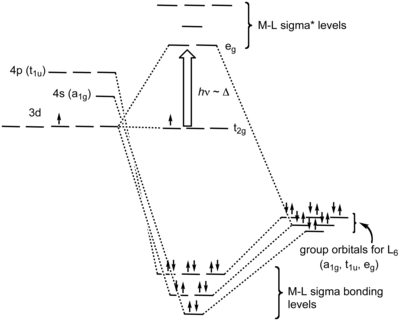
En términos de simetría molecular , los seis orbitales de pares solitarios de los ligandos (uno de cada ligando) forman seis combinaciones lineales adaptadas a la simetría (SALC) de orbitales, también llamadas a veces orbitales del grupo de ligandos (LGO). Las representaciones irreducibles que abarcan son a 1g , t 1u y e g . El metal también tiene seis orbitales de valencia que abarcan estas representaciones irreducibles : el orbital s está etiquetado como a 1g , un conjunto de tres orbitales p está etiquetado como t 1u y los orbitales d z 2 y d x 2 − y 2 están etiquetados como e g . Los seis orbitales moleculares de enlace σ resultan de las combinaciones de SALC de ligando con orbitales metálicos de la misma simetría. [8]
El enlace π en complejos octaédricos ocurre de dos maneras: a través de cualquier orbital p del ligando que no se esté utilizando en el enlace σ, y a través de cualquier orbital molecular π o π * presente en el ligando.
En el análisis habitual, los orbitales p del metal se utilizan para el enlace σ (y tienen la simetría incorrecta para superponerse con los orbitales p o π o π * del ligando de todos modos), por lo que las interacciones π tienen lugar con los orbitales d del metal apropiados , es decir, d xy , d xz y d yz . Estos son los orbitales que no son enlazantes cuando solo tiene lugar el enlace σ.
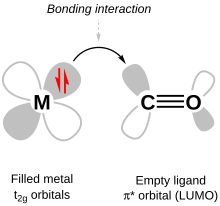
Un enlace π importante en los complejos de coordinación es el enlace π metal-ligando, también llamado enlace posterior π . Ocurre cuando los LUMO (orbitales moleculares desocupados más bajos) del ligando son orbitales π * antienlazantes . Estos orbitales están cerca en energía a los orbitales d xy , d xz y d yz , con los que se combinan para formar orbitales de enlace (es decir, orbitales de menor energía que el conjunto mencionado anteriormente de orbitales d ). Los orbitales antienlazantes correspondientes tienen mayor energía que los orbitales antienlazantes del enlace σ, por lo que, después de que los nuevos orbitales de enlace π se llenan con electrones de los orbitales d del metal , Δ O ha aumentado y el enlace entre el ligando y el metal se fortalece. Los ligandos terminan con electrones en su orbital molecular π * , por lo que el enlace π correspondiente dentro del ligando se debilita.
La otra forma de coordinación de enlaces π es el enlace ligando-metal. Esta situación surge cuando los orbitales p o π de simetría π de los ligandos están llenos. Se combinan con los orbitales d xy , d xz y d yz del metal y donan electrones al orbital de enlace de simetría π resultante entre ellos y el metal. El enlace metal-ligando se fortalece un poco por esta interacción, pero el orbital molecular antienlazante complementario del enlace ligando-metal no tiene mayor energía que el orbital molecular antienlazante del enlace σ. Sin embargo, está lleno de electrones de los orbitales d del metal , convirtiéndose en el HOMO (orbital molecular más ocupado) del complejo. Por esa razón, Δ O disminuye cuando se produce el enlace ligando-metal.
La mayor estabilización que resulta de la unión metal-ligando se debe a la donación de carga negativa del ion metálico hacia los ligandos. Esto permite que el metal acepte los enlaces σ con mayor facilidad. La combinación de enlaces σ de ligando a metal y enlaces π de metal a ligando es un efecto sinérgico , ya que cada uno potencia al otro.
Como cada uno de los seis ligandos tiene dos orbitales de simetría π, hay doce en total. Las combinaciones lineales de estos, adaptadas a la simetría, se dividen en cuatro representaciones irreducibles triplemente degeneradas, una de las cuales es de simetría t 2g . Los orbitales d xy , d xz y d yz del metal también tienen esta simetría, y por lo tanto los enlaces π formados entre un metal central y seis ligandos también la tienen (ya que estos enlaces π se forman simplemente por la superposición de dos conjuntos de orbitales con simetría t 2g ).
Los seis orbitales moleculares de enlace que se forman se "llenan" con los electrones de los ligandos, y los electrones de los orbitales d del ion metálico ocupan los OM no enlazantes y, en algunos casos, los antienlazantes. La diferencia de energía entre los dos últimos tipos de OM se denomina Δ O (O significa octaédrico) y está determinada por la naturaleza de la interacción π entre los orbitales del ligando y los orbitales d del átomo central. Como se describió anteriormente, los ligandos donantes π dan lugar a un Δ O pequeño y se denominan ligandos de campo débil o bajo, mientras que los ligandos aceptores π dan lugar a un valor grande de Δ O y se denominan ligandos de campo fuerte o alto. Los ligandos que no son ni donantes π ni aceptores π dan un valor de Δ O intermedio.
El tamaño de Δ O determina la estructura electrónica de los iones d 4 - d 7 . En complejos de metales con estas configuraciones de electrones d , los orbitales moleculares no enlazantes y antienlazantes se pueden llenar de dos maneras: una en la que se colocan tantos electrones como sea posible en los orbitales no enlazantes antes de llenar los orbitales antienlazantes, y otra en la que se colocan tantos electrones desapareados como sea posible. El primer caso se llama espín bajo, mientras que el segundo se llama espín alto. Un Δ O pequeño se puede superar con la ganancia energética de no aparear los electrones, lo que lleva a un espín alto. Sin embargo, cuando Δ O es grande, la energía de apareamiento de espín se vuelve insignificante en comparación y surge un estado de espín bajo.
La serie espectroquímica es una lista de ligandos derivada empíricamente ordenada por el tamaño del desdoblamiento Δ que producen. Se puede ver que los ligandos de campo bajo son todos π-donantes (como I − ), los ligandos de campo alto son π-aceptores (como CN − y CO), y los ligandos como H 2 O y NH 3 , que no son ninguno, están en el medio.
I − < Br − < S 2− < SCN − < Cl − < NO 3 − < N 3 − < F − < OH − < C 2 O 4 2− < H 2 O < NCS − < CH 3 CN < py ( piridina ) < NH 3 < en ( etilendiamina ) < bipy ( 2,2'-bipiridina ) < phen (1,10- fenantrolina ) < NO 2 − < PPh 3 < CN − < CO