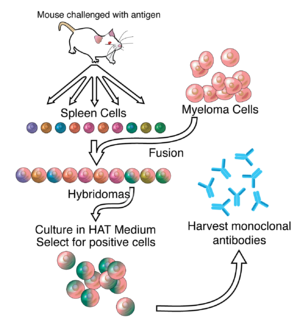
La tecnología de hibridoma es un método para producir una gran cantidad de anticuerpos idénticos (también llamados anticuerpos monoclonales ). Este proceso comienza inyectando a un ratón (u otro mamífero) un antígeno que provoca una respuesta inmune. Un tipo de glóbulo blanco, la célula B , produce anticuerpos que se unen al antígeno inyectado. Estas células B productoras de anticuerpos luego se recolectan del ratón y, a su vez, se fusionan con células cancerosas de mieloma inmortales (las células de mieloma son células plasmáticas cancerosas; las células plasmáticas se derivan de células B activadas), para producir una línea celular híbrida llamada hibridoma. , que tiene tanto la capacidad de producción de anticuerpos de las células B como la longevidad y reproductividad del mieloma. Los hibridomas se pueden cultivar en cultivo, comenzando cada cultivo con una célula de hibridoma viable, produciendo cultivos cada uno de los cuales consta de hibridomas genéticamente idénticos que producen un anticuerpo por cultivo (monoclonal) en lugar de mezclas de diferentes anticuerpos (policlonal). La línea celular de mieloma que se utiliza en este proceso se selecciona por su capacidad para crecer en cultivo de tejidos y por su ausencia de síntesis de anticuerpos. A diferencia de los anticuerpos policlonales , que son mezclas de muchas moléculas de anticuerpos diferentes, los anticuerpos monoclonales producidos por cada línea de hibridoma son todos químicamente idénticos.
La producción de anticuerpos monoclonales fue inventada por César Milstein y Georges JF Köhler en 1975. Compartieron el Premio Nobel de Medicina y Fisiología de 1984 con Niels Kaj Jerne , quien hizo otras contribuciones a la inmunología. El término hibridoma fue acuñado por Leonard Herzenberg durante su año sabático en el laboratorio de César Milstein en 1976-1977. [1]
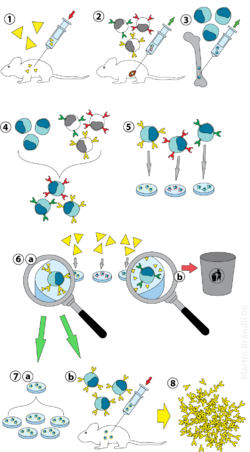

En primer lugar se exponen animales de laboratorio ( mamíferos , p. ej. ratones) al antígeno contra el que se va a generar un anticuerpo. Normalmente esto se hace mediante una serie de inyecciones del antígeno en cuestión, a lo largo de varias semanas. Estas inyecciones suelen ir seguidas del uso de electroporación in vivo , que mejora significativamente la respuesta inmune. Una vez que se aíslan los esplenocitos del bazo del mamífero , las células B se fusionan con células de mieloma inmortalizadas. La fusión de las células B con células de mieloma se puede realizar mediante electrofusión. La electrofusión hace que las células B y las células de mieloma se alineen y fusionen con la aplicación de un campo eléctrico. Alternativamente, se puede hacer que las células B y los mielomas se fusionen mediante protocolos químicos, utilizando con mayor frecuencia polietilenglicol . Las células de mieloma se seleccionan de antemano para garantizar que no secreten anticuerpos y que carezcan del gen de hipoxantina-guanina fosforribosiltransferasa (HGPRT), lo que las hace sensibles (o vulnerables) al medio HAT (ver más abajo).
Las células fusionadas se incuban en medio HAT ( hipoxantina - aminopterina - medio timidina ) durante aproximadamente 10 a 14 días. La aminopterina bloquea la vía que permite la síntesis de nucleótidos. Por lo tanto, las células de mieloma no fusionadas mueren, ya que no pueden producir nucleótidos mediante las vías de novo o de rescate porque carecen de HGPRT. La eliminación de las células de mieloma no fusionadas es necesaria porque tienen el potencial de crecer más que otras células, especialmente los hibridomas débilmente establecidos. Las células B no fusionadas mueren porque tienen una vida corta. De esta manera, sólo sobreviven los híbridos de células B y mieloma, ya que el gen HGPRT procedente de las células B es funcional. Estas células producen anticuerpos (una propiedad de las células B) y son inmortales (una propiedad de las células de mieloma). A continuación, el medio incubado se diluye en placas de varios pocillos hasta tal punto que cada pocillo contenga sólo una célula. Dado que los anticuerpos de un pocillo son producidos por la misma célula B, se dirigirán hacia el mismo epítopo y, por tanto, son anticuerpos monoclonales.
La siguiente etapa es un rápido proceso de detección primaria, que identifica y selecciona sólo aquellos hibridomas que producen anticuerpos de especificidad adecuada. La primera técnica de cribado utilizada se denomina ELISA . Luego se incuban el sobrenadante del cultivo de hibridoma, el conjugado marcado con enzima secundaria y el sustrato cromogénico, y la formación de un producto coloreado indica un hibridoma positivo. Alternativamente, inmunocitoquímica, [2] Western blot y espectrometría de masas por inmunoprecipitación. A diferencia de los ensayos de transferencia Western, la espectrometría de masas por inmunoprecipitación facilita la detección y clasificación de clones que se unen a las formas nativas (no desnaturalizadas) de proteínas antigénicas. [3] La detección por citometría de flujo se ha utilizado para la detección primaria de un gran número (~1000) de clones de hibridoma que reconocen la forma nativa del antígeno en la superficie celular. [4] En el cribado basado en citometría de flujo, se utiliza una mezcla de células con antígeno negativo y células con antígeno positivo como antígeno que se va a analizar para cada muestra de sobrenadante de hibridoma. [4]
La célula B que produce los anticuerpos deseados se puede clonar para producir muchos clones hijos idénticos. Para este paso son esenciales medios suplementarios que contengan interleucina-6 (como briclona). Una vez establecida una colonia de hibridoma, crecerá continuamente en un medio de cultivo como RPMI-1640 (con antibióticos y suero bovino fetal) y producirá anticuerpos. [2]
Inicialmente se utilizan placas multipocillo para hacer crecer los hibridomas y, después de la selección, se cambian a matraces de cultivo de tejidos más grandes. Esto mantiene el bienestar de los hibridomas y proporciona suficientes células para la criopreservación y sobrenadante para investigaciones posteriores. El sobrenadante del cultivo puede producir de 1 a 60 μg/ml de anticuerpo monoclonal, que se mantiene a -20 °C o menos hasta que se necesite. [2]
Utilizando sobrenadante de cultivo o una preparación de inmunoglobulina purificada, se pueden realizar análisis adicionales de un posible anticuerpo monoclonal que produce hibridoma en términos de reactividad, especificidad y reactividad cruzada. [2]
El uso de anticuerpos monoclonales es numeroso e incluye la prevención, diagnóstico y tratamiento de enfermedades. Por ejemplo, los anticuerpos monoclonales pueden distinguir subconjuntos de células B y células T , lo que resulta útil para identificar diferentes tipos de leucemias . Además, se han utilizado anticuerpos monoclonales específicos para definir marcadores de superficie celular en glóbulos blancos y otros tipos de células. Esto condujo al grupo de series de marcadores de diferenciación . A menudo se los denomina marcadores de CD y definen varios cientos de componentes diferentes de la superficie celular de las células, cada uno de los cuales se especifica mediante la unión de un anticuerpo monoclonal particular. Estos anticuerpos son extremadamente útiles para la clasificación de células activadas por fluorescencia , el aislamiento específico de tipos particulares de células.
Con la ayuda de anticuerpos monoclonales, los tejidos y órganos se pueden clasificar en función de la expresión de ciertos marcadores definidos, que reflejan la génesis tisular o celular. El antígeno prostático específico , la fosfatasa alcalina placentaria , la gonadotropina coriónica humana , la α-fetoproteína y otros son antígenos asociados a órganos y la producción de anticuerpos monoclonales contra estos antígenos ayuda a determinar la naturaleza de un tumor primario. [2]
Los anticuerpos monoclonales son especialmente útiles para distinguir lesiones morfológicamente similares, como mesotelioma pleural y peritoneal , adenocarcinoma , y en la determinación del origen orgánico o tisular de metástasis indiferenciadas . Los anticuerpos monoclonales seleccionados ayudan en la detección de metástasis ocultas ( cáncer de origen primario desconocido ) mediante análisis inmunocitológico de médula ósea, aspirados de otros tejidos, así como ganglios linfáticos y otros tejidos, y pueden tener una mayor sensibilidad que la tinción histopatológica normal . [2]
Un estudio [5] realizó un ensayo inmunohistoquímico sensible en aspirados de médula ósea de 20 pacientes con cáncer de próstata localizado. En el ensayo se utilizaron tres anticuerpos monoclonales (T16, C26 y AE-1), capaces de reconocer antígenos de membrana y citoesqueléticos expresados por células epiteliales para detectar células tumorales. Aspirados de médula ósea del 22% de los pacientes con cáncer de próstata localizado (estadio B, 0/5; estadio C, 2/4) y del 36% de los pacientes con cáncer de próstata metastásico (estadio D1, 0/7 pacientes; estadio D2, 4/ 4 pacientes) tenían células positivas para antígeno en la médula ósea. Se concluyó que la tinción inmunohistoquímica de aspirados de médula ósea es muy útil para detectar metástasis ocultas en la médula ósea en pacientes con cáncer de próstata aparentemente localizado.
Aunque la inmunocitoquímica que utiliza anticuerpos monoclonales asociados a tumores ha mejorado la capacidad de detectar células de cáncer de mama ocultas en aspirados de médula ósea y sangre periférica, es necesario un mayor desarrollo de este método antes de que pueda usarse de forma rutinaria. [6] Un inconveniente importante de la inmunocitoquímica es que sólo se utilizan anticuerpos monoclonales asociados a tumores y no específicos de tumores y, como resultado, puede producirse cierta reacción cruzada con células normales. [7]
Para estadificar eficazmente el cáncer de mama y evaluar la eficacia de los regímenes de purga antes de la infusión de células madre autólogas, es importante detectar incluso pequeñas cantidades de células de cáncer de mama. Los métodos inmunohistoquímicos son ideales para este fin porque son simples, sensibles y bastante específicos. Franklin y cols. [8] realizaron un ensayo inmunocitoquímico sensible utilizando una combinación de cuatro anticuerpos monoclonales (260F9, 520C9, 317G5 y BrE-3) contra glicoproteínas de la superficie de las células tumorales para identificar células tumorales de mama en la médula ósea y la sangre periférica. A partir de los resultados, concluyeron que la tinción inmunocitoquímica de la médula ósea y la sangre periférica es una forma sensible y sencilla de detectar y cuantificar las células del cáncer de mama.
Una de las principales razones de la recaída metastásica en pacientes con tumores sólidos es la diseminación temprana de células malignas. El uso de anticuerpos monoclonales (mAb) específicos para citoqueratinas puede identificar células tumorales epiteliales individuales diseminadas en la médula ósea.
Un estudio [9] informa haber desarrollado un procedimiento inmunocitoquímico para el marcaje simultáneo del componente citoqueratina no. 18 (CK18) y antígeno prostático específico (PSA). Esto ayudaría en la caracterización adicional de células tumorales epiteliales individuales diseminadas en pacientes con cáncer de próstata. Los doce aspirados de control de pacientes con hipertrofia prostática benigna mostraron tinción negativa, lo que respalda aún más la especificidad de CK18 en la detección de células tumorales epiteliales en la médula ósea.
En la mayoría de los casos de enfermedad maligna complicada con derrame, las células neoplásicas se pueden reconocer fácilmente. Sin embargo, en algunos casos, las células malignas no se ven tan fácilmente o su presencia es demasiado dudosa como para considerarlo un informe positivo. El uso de técnicas inmunocitoquímicas aumenta la precisión diagnóstica en estos casos.
Ghosh, Mason y Spriggs [10] analizaron 53 muestras de líquido pleural o peritoneal de 41 pacientes con enfermedad maligna. El examen citológico convencional no reveló células neoplásicas. Se utilizaron tres anticuerpos monoclonales (anti-CEA, Ca 1 y HMFG-2) para buscar células malignas. El marcaje inmunocitoquímico se realizó en frotis sin teñir, que habían sido almacenados a -20 °C durante un máximo de 18 meses. Doce de los cuarenta y un casos en los que se realizó tinción inmunocitoquímica revelaron células malignas. El resultado representó un aumento en la precisión diagnóstica de aproximadamente el 20%. El estudio concluyó que en pacientes con sospecha de enfermedad maligna, el marcado inmunocitoquímico debe usarse de forma rutinaria en el examen de muestras citológicamente negativas y tiene implicaciones importantes con respecto al manejo del paciente.
Otra aplicación de la tinción inmunocitoquímica es la detección de dos antígenos en el mismo frotis. La doble tinción con anticuerpos de cadena ligera y con marcadores de células T y B puede indicar el origen neoplásico de un linfoma. [11]
Un estudio ha informado del aislamiento de una línea celular de hibridoma (clon 1E10), que produce un anticuerpo monoclonal (IgM, isotipo k). Este anticuerpo monoclonal muestra una tinción inmunocitoquímica específica de los nucléolos. [12]
Los tejidos y tumores se pueden clasificar en función de la expresión de ciertos marcadores, con la ayuda de anticuerpos monoclonales. Ayudan a distinguir lesiones morfológicamente similares y a determinar el origen de órganos o tejidos de metástasis indiferenciadas. El análisis inmunocitológico de médula ósea, aspirados de tejido, ganglios linfáticos, etc. con anticuerpos monoclonales seleccionados ayuda a detectar metástasis ocultas. Los anticuerpos monoclonales aumentan la sensibilidad para detectar incluso pequeñas cantidades de células invasivas o metastásicas. Los anticuerpos monoclonales (mAb) específicos para las citoqueratinas pueden detectar células tumorales epiteliales individuales diseminadas en la médula ósea.