La replicación viral es la formación de virus biológicos durante el proceso de infección en las células huésped diana. Los virus deben primero entrar en la célula para que pueda producirse la replicación viral. Mediante la generación de abundantes copias de su genoma y el empaquetamiento de estas copias, el virus continúa infectando nuevos huéspedes. La replicación entre virus es muy variada y depende del tipo de genes implicados en ellos. La mayoría de los virus ADN se ensamblan en el núcleo, mientras que la mayoría de los virus ARN se desarrollan únicamente en el citoplasma. [1]
Los virus se multiplican únicamente en células vivas. La célula huésped debe proporcionar la energía , la maquinaria sintética y los precursores de bajo peso molecular para la síntesis de proteínas y ácidos nucleicos virales. [2]
La replicación del virus ocurre en siete etapas:
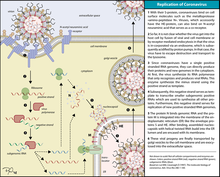
Es el primer paso de la replicación viral. Algunos virus se adhieren a la membrana celular de la célula huésped e inyectan su ADN o ARN en el huésped para iniciar la infección. La adhesión a una célula huésped a menudo se logra mediante una proteína de adhesión del virus que se extiende desde la cubierta proteica, también conocida como cápside , de un virus. Esta proteína es responsable de la unión a un receptor de superficie en la membrana plasmática (o carbohidratos de membrana) de una célula huésped. Los virus pueden explotar las funciones normales del receptor celular para permitir que se produzca la adhesión imitando las moléculas que se unen a los receptores de la célula huésped. Por ejemplo, el rinovirus utiliza su proteína de adhesión del virus para unirse al receptor ICAM-1 en las células huésped que normalmente se utiliza para facilitar la adhesión entre otras células huésped. [3]
La entrada, o penetración, es el segundo paso en la replicación viral. Este paso se caracteriza por el paso del virus a través de la membrana plasmática de la célula huésped. La forma más común en que un virus logra entrar en la célula huésped es mediante endocitosis mediada por receptores , que no tiene ningún costo energético para el virus, solo para la célula huésped. La endocitosis mediada por receptores ocurre cuando una molécula (en este caso un virus) se une a un receptor en la membrana de la célula. Una serie de señales químicas de esta unión hace que la célula envuelva al virus adherido en la membrana plasmática a su alrededor formando una vesícula que contiene el virus dentro de la célula. [3]
Los virus entran en las células huésped mediante una variedad de mecanismos, incluidas las rutas endocíticas y no endocíticas. [4] También pueden fusionarse en la membrana plasmática y pueden propagarse dentro del huésped a través de la fusión o fusión célula-célula. [5] Los virus se adhieren a las proteínas en la superficie de la célula huésped conocidas como receptores celulares o factores de adhesión para ayudar a la entrada. [6] La evidencia muestra que los virus utilizan canales iónicos en las células huésped durante la entrada viral. Fusión: Las proteínas virales externas promueven la fusión del virión con la membrana plasmática. [7] Esto forma un poro en la membrana del huésped, y después de la entrada, el virión queda sin cubierta y su material genómico luego se transfiere al citoplasma. [8] Fusión de célula a célula: Algunos virus estimulan la expresión de proteínas específicas en las superficies de las células infectadas para atraer células no infectadas. [9] Esta interacción hace que la célula no infectada se fusione con la célula infectada a niveles de pH más bajos para formar una célula multinuclear conocida como sincitio. [10] Vías endocíticas: proceso por el cual se forma una vesícula intracelular por invaginación de la membrana, lo que da como resultado la ingestión de componentes extracelulares y unidos a la membrana, en este contexto, un virus. [11] Vías no endocíticas: proceso por el cual las partículas virales se liberan en la célula por fusión de la envoltura viral extracelular y la membrana de la célula huésped. [4]
El desprendimiento de la envoltura es el tercer paso en la replicación viral. El desprendimiento de la envoltura se define como la eliminación de la "envoltura" proteica del virión y la liberación de su material genético. Este paso ocurre en la misma área en la que ocurre la transcripción viral. Diferentes virus tienen diversos mecanismos para el desprendimiento de la envoltura. Algunos virus de ARN, como los rinovirus, utilizan el pH bajo en los endosomas de una célula huésped para activar su mecanismo de desprendimiento de la envoltura. Esto implica que el rinovirus libera una proteína que crea agujeros en el endosoma y permite que el virus libere su genoma a través de los agujeros. Muchos virus de ADN viajan al núcleo de la célula huésped y liberan su material genético a través de los poros nucleares. [3]
El cuarto paso del ciclo viral es la replicación, que se define por la rápida producción del genoma viral. La forma en que un virus experimenta la replicación depende del tipo de material genético que posee el virus. En función de su material genético, los virus secuestrarán la maquinaria celular correspondiente para dicho material genético. Los virus que contienen ADN de doble cadena (dsDNA) comparten el mismo tipo de material genético que todos los organismos y, por lo tanto, pueden utilizar las enzimas de replicación en el núcleo de la célula huésped para replicar el genoma viral. Muchos virus de ARN normalmente se replican en el citosol y pueden acceder directamente a los ribosomas de la célula huésped para fabricar proteínas virales una vez que el ARN está en forma replicativa.
Los virus pueden atravesar dos tipos de ciclos de vida: el ciclo lítico y el ciclo lisogénico. En el ciclo lítico, el virus introduce su genoma en una célula huésped e inicia la replicación secuestrando la maquinaria celular del huésped para hacer nuevas copias del virus. [12] En el ciclo de vida lisogénico, el genoma viral se incorpora al genoma del huésped. El genoma del huésped atravesará su ciclo de vida normal, replicándose y dividiéndose, replicando el genoma viral junto con el suyo propio. [13] El genoma viral puede ser activado para comenzar la producción viral a través de estimulantes químicos y ambientales. [14] Una vez que un virus lisogénico entra en el ciclo de vida lítico, continuará en las vías de producción viral y procederá con la transcripción / producción de ARNm. (p. ej.: herpes labial, virus del herpes simple (HSV)-1, bacteriófagos lisogénicos, etc.)
El ensamblaje es el proceso en el que las proteínas y genomas virales recién fabricados se reúnen y se juntan para formar virus inmaduros. Al igual que en los otros pasos, la forma en que se ensambla un virus en particular depende del tipo de virus que sea. El ensamblaje puede ocurrir en la membrana plasmática, el citosol, el núcleo, el aparato de Golgi y otras ubicaciones dentro de la célula huésped. Algunos virus solo insertan su genoma en una cápside una vez que esta se completa, mientras que en otros virus la cápside envolverá al genoma a medida que se copia. [2]
Este es el paso final antes de que se forme un virus competente. Esto generalmente implica modificaciones de la cápside que se proporcionan a las enzimas (codificadas por el huésped o por el virus). [3]
El paso final de la replicación viral es la liberación, que es cuando los virus recién ensamblados y maduros abandonan la célula huésped. La forma en que un virus se libera de la célula huésped depende del tipo de virus que sea. Un tipo común de liberación es la gemación. Esto ocurre cuando los virus que forman su envoltura a partir de la membrana plasmática del huésped doblan la membrana alrededor de la cápside. A medida que el virus dobla la membrana plasmática, comienza a envolver toda la cápside hasta que el virus ya no está adherido a la célula huésped. Otra forma común en que los virus abandonan la célula huésped es a través de la lisis celular , donde los virus lisan la célula haciendo que estalle, lo que libera los virus maduros que estaban en la célula huésped. [3]
Los virus se clasifican en siete tipos de genes, cada uno de los cuales tiene sus propias familias de virus, que a su vez tienen diferentes estrategias de replicación. [15] David Baltimore , un biólogo ganador del Premio Nobel , ideó un sistema llamado Sistema de Clasificación de Baltimore para clasificar diferentes virus en función de su estrategia de replicación única. Hay siete estrategias de replicación diferentes basadas en este sistema (Clase Baltimore I, II, III, IV, V, VI, VII). Las siete clases de virus se enumeran aquí brevemente y en generalidades. [16]
Este tipo de virus normalmente debe entrar en el núcleo del huésped antes de poder replicarse. Algunos de estos virus requieren polimerasas de la célula huésped para replicar su genoma , mientras que otros, como los adenovirus o los virus del herpes, codifican sus propios factores de replicación. Sin embargo, en ambos casos, la replicación del genoma viral depende en gran medida de un estado celular permisivo para la replicación del ADN y, por lo tanto, del ciclo celular . El virus puede inducir a la célula a sufrir una división celular forzada , lo que puede conducir a la transformación de la célula y, en última instancia, al cáncer . Un ejemplo de una familia dentro de esta clasificación es Adenoviridae .
Sólo existe un ejemplo bien estudiado en el que una familia de virus de clase 1 no se replica dentro del núcleo. Se trata de la familia Poxvirus , que comprende virus altamente patógenos que infectan a los vertebrados .
Los virus que entran en esta categoría incluyen aquellos que no han sido tan estudiados, pero que aún así son muy comunes en los vertebrados. Dos ejemplos son los Circoviridae y los Parvoviridae . Se replican dentro del núcleo y forman un intermediario de ADN de doble cadena durante la replicación. Un Anellovirus humano llamado TTV se incluye dentro de esta clasificación y se encuentra en casi todos los humanos, infectándolos asintomáticamente en casi todos los órganos principales .
Virus ARN: La polimerasa de los virus ARN carece de las funciones de corrección de errores que se encuentran en la polimerasa de los virus ADN. Esto contribuyó a que los virus ARN tuvieran una fidelidad replicativa menor en comparación con los virus ADN, lo que provocó que los virus ARN fueran altamente mutagénicos, lo que puede aumentar su tasa de supervivencia general. [17] Los virus ARN carecen de la capacidad de identificar y reparar nucleótidos mal emparejados o dañados y, por lo tanto, los genomas de ARN son propensos a mutaciones introducidas por mecanismos intrínsecos y extrínsecos a la replicación viral. [18] Los virus ARN presentan un arma terapéutica de doble filo: los virus ARN pueden resistir el desafío de los medicamentos antivirales, causar epidemias e infectar múltiples especies hospedadoras debido a su naturaleza mutagénica, lo que los hace difíciles de tratar. Sin embargo, la proteína transcriptasa inversa que a menudo viene con el virus ARN se puede utilizar como un objetivo indirecto para los virus ARN, lo que evita la transcripción y la síntesis de partículas virales. [19] (Esta es la base de los medicamentos contra el SIDA y el VIH [20] )
Al igual que la mayoría de los virus con genomas de ARN , los virus de ARN bicatenario no dependen de las polimerasas del huésped para replicarse en la medida en que lo hacen los virus con genomas de ADN . Los virus de ARN bicatenario no se han estudiado tan bien como otras clases. Esta clase incluye dos familias principales, Reoviridae y Birnaviridae . La replicación es monocistrónica e incluye genomas individuales y segmentados, lo que significa que cada uno de los genes codifica solo una proteína, a diferencia de otros virus, que presentan una traducción más compleja.
Estos virus se dividen en dos tipos, pero ambos comparten el hecho de que la replicación se produce principalmente en el citoplasma y no depende tanto del ciclo celular como en el caso de los virus de ADN. Esta clase de virus es también uno de los más estudiados, junto con los virus de ADN de doble cadena.
Los virus ARN de sentido positivo y, de hecho, todos los genes definidos como de sentido positivo pueden ser accedidos directamente por los ribosomas del huésped para formar inmediatamente proteínas. Estos pueden dividirse en dos grupos, los cuales se replican en el citoplasma:
Ejemplos de esta clase incluyen las familias Coronaviridae , Flaviviridae y Picornaviridae .
Los virus de ARN de sentido negativo y, de hecho, todos los genes definidos como de sentido negativo no pueden ser accedidos directamente por los ribosomas del huésped para formar proteínas de inmediato. En cambio, deben ser transcritos por las polimerasas virales en el sentido positivo complementario "legible". Estos también pueden dividirse en dos grupos:
Los ejemplos de esta clase incluyen las familias Orthomyxoviridae , Paramyxoviridae , Bunyaviridae , Filoviridae y Rhabdoviridae (que incluye la rabia ).
Una familia muy estudiada de esta clase de virus son los retrovirus . Una característica definitoria es el uso de la transcriptasa inversa para convertir el ARN de sentido positivo en ADN. En lugar de utilizar el ARN como plantilla de proteínas, utilizan el ADN para crear las plantillas, que se empalma en el genoma del huésped mediante la integrasa . La replicación puede entonces comenzar con la ayuda de las polimerasas de la célula huésped.
Este pequeño grupo de virus, ejemplificado por el virus de la hepatitis B , tiene un genoma bicatenario con huecos que posteriormente se rellena para formar un círculo cerrado covalentemente ( ADNccc ) que sirve como plantilla para la producción de ARNm virales y un ARN subgenómico . El ARN pregenómico sirve como plantilla para la transcriptasa inversa viral y para la producción del genoma de ADN.