La proteína Rab-7a relacionada con Ras es una proteína que en los humanos está codificada por el gen RAB7A . [5] [6]
La proteína Rab-7a relacionada con Ras participa en la endocitosis , que es un proceso que introduce sustancias en una célula. El proceso de endocitosis funciona doblando la membrana celular alrededor de una sustancia fuera de la célula (por ejemplo, una proteína) y luego forma una vesícula . Luego, la vesícula ingresa a la célula y se escinde de la membrana celular. RAB7A juega un papel importante en el movimiento de vesículas hacia el interior de la célula, así como en el tráfico de vesículas. [7]
Varias mutaciones de RAB7A están asociadas con la neuropatía sensorial hereditaria tipo 1C (HSN IC), también conocida como síndrome de Charcot-Marie-Tooth tipo 2B (CMT2B). [8]

Los miembros de la familia RAB de proteínas de unión a GTP relacionadas con RAS son importantes reguladores del transporte vesicular y están ubicados en compartimentos intracelulares específicos. RAB7 se ha localizado en endosomas tardíos y ha demostrado ser importante en la vía endocítica tardía. Además, se ha demostrado que tiene un papel fundamental en la vacuolación celular inducida por la citotoxina VacA de Helicobacter pylori . [9]
RAB7A funciona como un regulador clave en el tráfico endolisosomal, gobierna la maduración endosómica temprana a tardía, la migración y las posiciones endosómicas dirigidas desde el extremo negativo y positivo de los microtúbulos, y el transporte endosoma-lisosoma a través de diferentes cascadas de interacción proteína-proteína .
RAB7A también participa en la regulación de cierto tráfico especializado de membranas endosómicas , como la maduración de melanosomas mediante la modulación de SOX10 y el oncogén MYC . Las mutaciones en la vía lisosomal dan como resultado la progresión tumoral en las células de melanoma.
RAB7 se expresa ampliamente; Se encuentra una alta expresión en el músculo esquelético [10] , ya que desempeña un papel en el transporte retrógrado de largo alcance de los endosomas de señalización en los axones .
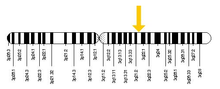
El gen RAB7A se encuentra en el cromosoma 3 de los humanos, específicamente en el brazo q largo desde el par de bases 128.726.135 al 128.814.797. La ubicación se encontró mediante un mapeo realizado por primera vez por Davies et al. en 1997 para mapear el gen RAB7A en el cromosoma 3 mediante análisis por PCR . [5] En 1995, Barbosa et al. lo habían mapeado en el cromosoma 9 en ratones. Finalmente, utilizando hibridación fluorescente in situ (FISH), Kashuba et al. pudieron mapear el gen RAB7A en 3q21 en 1997. [6]
RAB7a se clonó examinando una biblioteca de ADNc de placenta humana con un ADNc de Rab7 de rata para mostrar que el ADNc de RAB7a codifica una proteína de 207 aminoácidos cuya secuencia es 99% idéntica a la de Rab7a de ratón, rata y perro y 61% idéntica a esa. de levadura Rab7a. Utilizando el análisis de transferencia Northern , Vitelli et al. (1996) encontraron que RAB7a se expresaba como transcritos de 1,7 y 2,5 kb en todas las líneas celulares examinadas, pero que había una gran diferencia en la cantidad total de ARNm de RAB7a entre las líneas celulares. [11]

Está relacionado con que los niveles y la función de RAB7a eran independientes de los factores de transcripción específicos del linaje de los melanocitos ( MITF ), pero investigaciones recientes han demostrado que SOX10 (un modulador maestro neuroectodérmico) y MYC (un oncogén) son los principales reguladores. Rab7a está regulado por SOX10 y MYC respectivamente en un cableado específico del linaje. Los estudios muestran que RAB7a puede regularse específicamente mediante formas independientes de MITF, como cambiar los niveles de SOX10 o MYC, para afectar la proliferación tumoral, especialmente en el melanoma [14] .
En estudios que utilizan ARN antisentido , la regulación negativa de la expresión del gen RAB7 en células HeLa que utilizan ARN antisentido induce una vacuolación celular grave que se asemeja al fenotipo observado en los fibroblastos de pacientes con síndrome de Chédiak-Higashi . [12]
En presencia de factor de crecimiento , la inhibición del factor de crecimiento de Rab7 de mamíferos no tuvo efecto sobre la expresión del transportador de nutrientes en células pro-linfocíticas B de ratón. Sin embargo, en las células privadas de factor de crecimiento, el bloqueo de la función de Rab7 impidió la eliminación de las proteínas transportadoras de glucosa y aminoácidos de la superficie celular. Cuando se inhibió Rab7, las células privadas de factor de crecimiento mantuvieron su potencial de membrana mitocondrial y mostraron una supervivencia celular prolongada, independiente del factor de crecimiento y dependiente de nutrientes. Los autores concluyeron que RAB7 funciona como una proteína proapoptótica al limitar la absorción de nutrientes por parte de las células autónomas. [13]
Se ha demostrado que RAB7A interactúa con RILP [14] [15] y CHM . [16] [17] Se ha demostrado que RILP tiene un papel clave en el control del transporte a compartimentos degradativos junto con Rab7 y puede vincular la función de Rab7 con el citoesqueleto . RILP desempeña el papel de efector posterior de Rab7 y, juntas, ambas proteínas actúan para regular el tráfico endocítico tardío. [18]
RAB7A interactúa directamente con Rubicon cuando RAB7A está vinculado a GTP. Rubicon es un regulador negativo de la autofagia . [19]
Otras interacciones clave incluyen RAC1 (por similitud), NTRK1/TRKA (por similitud), C9orf72 (por similitud), CHM (la subunidad de unión al sustrato del complejo Rab geranilgeraniltransferasa) y RILP, [20] así como PSMA7 , RNF115 y FYCO1. Interactúa con el complejo PIK3C3/VPS34-PIK3R4. La forma vinculada a GTP interactúa con OSBPL1A y CLN3 . [21] También se demostró que Rab7A interactúa con el complejo retrómero , muy probablemente a través de la subunidad Vps35. [22]
RAB7 es una pequeña GTPasa que tiene el potencial de causar malignidad en más de 35 tipos de tumores. Se ha descubierto que RAB7 es un impulsor temprano del melanoma inducido cuyos niveles pueden definir el riesgo metastásico. El gen RAB7A pertenece a la familia de genes RAB , que es miembro de la familia de oncogén RAS . Estos genes de la familia RAB proporcionan las instrucciones necesarias para producir proteínas para el tráfico de vesículas. Estas proteínas son GTPasas y actúan como un interruptor que las moléculas de GTP y GDP encienden y apagan . [7]
Las células de melanoma conservan una memoria de desarrollo que refleja un cableado único de vías de tráfico de vesículas. Se considera que Rab7 controla el potencial proliferativo e invasivo de estos tumores agresivos tras la identificación de un grupo de genes endolisosomales enriquecidos en melanoma . La degradación asociada a lisosomas, una característica universal de las células eucariotas , puede secuestrarse de una manera dependiente del tipo de tumor y del estadio. Descubrir que RAB7 está controlado por SOX10 y MYC de manera independiente del MITF tiene importantes implicaciones básicas y traslacionales. [23] Sox10 no es inhibido por mecanismos que regulan negativamente MITF, algunos de los cuales incluyen mutaciones BRAF , que son relativamente frecuentes en melanomas malignos. Esto puede asegurar una memoria de desarrollo en la expresión de RAB7. Se especula que la regulación negativa de RAB7 en el frente invasivo de los melanomas agresivos está modulada por mecanismos de tipo epitelial a mesenquimatoso, como los descritos recientemente que subyacen al cambio transcripcional asociado con los fenotipos prometastásicos. En otras palabras, existe una dependencia inherente de las células de melanoma de la pequeña GTPasa RAB7, identificada dentro de un grupo de genes lisosomales que distingue esta neoplasia maligna de más de 35 tipos de tumores. Los análisis en células humanas, muestras clínicas y modelos de ratón demostraron que RAB7 es un impulsor del melanoma inducido tempranamente cuyos niveles pueden ajustarse para favorecer la invasión tumoral, definiendo en última instancia el riesgo metastásico. Es importante destacar que los niveles y la función de RAB7 eran independientes de MITF y, en cambio, el modulador maestro neuroectodérmico SOX10 y el oncogén MYC son reguladores clave de RAB7a. [23]

También conocida como neuropatía de Charcot-Marie-Tooth, neuropatía motora y sensorial hereditaria (HMSN) y atrofia muscular peronea (PMA). Se trata de un grupo genética y clínicamente heterogéneo de trastornos hereditarios , caracterizados por una pérdida sensorial importante, a menudo complicada por ulceromutilaciones graves de los dedos de los pies o de los pies, y afectación motora variable. [24] [25] Las mutaciones sin sentido en RAB7A, el gen que codifica la pequeña GTPasa Rab7, causan CMT2B y aumentan la actividad de Rab7. Rab7 se expresa de forma ubicua y participa en la degradación a través de la vía lisosomal. Actualmente incurable, esta enfermedad es uno de los trastornos neurológicos hereditarios más comunes que afecta aproximadamente a 1 de cada 2500 personas, lo que equivale a aproximadamente 23 000 personas en el Reino Unido y 125 000 personas en los Estados Unidos. La CMT se clasificaba anteriormente como un subtipo de distrofia muscular . [26]