El síndrome de Hunter , o mucopolisacaridosis tipo II ( MPS II ), es un trastorno genético poco común en el que se acumulan en los tejidos corporales moléculas de azúcar grandes llamadas glicosaminoglicanos (o GAG o mucopolisacáridos). Es una forma de enfermedad de almacenamiento lisosomal . El síndrome de Hunter es causado por una deficiencia de la enzima lisosomal iduronato-2-sulfatasa (I2S). [2] [3] La falta de esta enzima hace que el heparán sulfato y el dermatán sulfato se acumulen en todos los tejidos corporales. [4] El síndrome de Hunter es el único síndrome de MPS que presenta una herencia recesiva ligada al cromosoma X. [4]
Los síntomas del síndrome de Hunter son comparables a los de la MPS I. Provoca anomalías en muchos órganos, incluidos el esqueleto, el corazón y el sistema respiratorio. En casos graves, esto conduce a la muerte durante la adolescencia. A diferencia de la MPS I, la opacidad corneal no está asociada con esta enfermedad. [1]
El síndrome de Hunter puede presentarse con una amplia variedad de fenotipos . Tradicionalmente se ha categorizado como "leve" o "grave" dependiendo de la presencia de síntomas del sistema nervioso central , pero esto es una simplificación excesiva. Los pacientes con formas "atenuadas" o "leves" de la enfermedad aún pueden tener problemas de salud importantes. Para los pacientes gravemente afectados, el curso clínico es relativamente predecible; los pacientes normalmente mueren a una edad temprana. Para aquellos con formas más leves de la enfermedad, existe una variedad más amplia de resultados. Muchos viven hasta los 20 y 30 años, pero algunos pueden tener una expectativa de vida casi normal. Las anomalías cardíacas y respiratorias son la causa habitual de muerte para los pacientes con formas más leves de la enfermedad. [2]
Los síntomas del síndrome de Hunter (MPS II) generalmente no son evidentes al nacer. A menudo, los primeros síntomas pueden incluir hernias abdominales , infecciones de oído , secreción nasal y resfriados . A medida que la acumulación de GAG continúa en las células del cuerpo, los signos de MPS II se vuelven más visibles. La apariencia física de muchos niños con el síndrome incluye una tosquedad distintiva en sus rasgos faciales, incluida una frente prominente , una nariz con un puente aplanado y una lengua agrandada . También pueden tener una cabeza grande , así como un abdomen agrandado. Para los casos graves de MPS II, el diagnóstico a menudo se realiza entre las edades de 18 y 36 meses. En los casos más leves, los pacientes se presentan de manera similar a los niños con síndrome de Hurler-Scheie , y el diagnóstico generalmente se realiza entre las edades de 4 y 8 años. [2]
El almacenamiento continuo de GAG conduce a anomalías en múltiples sistemas orgánicos. Después de 18 meses, los niños con MPS II grave pueden experimentar un deterioro del desarrollo y una pérdida progresiva de habilidades. [1] El engrosamiento de las válvulas cardíacas y las paredes del corazón puede provocar un deterioro progresivo de la función cardíaca. Las paredes de las vías respiratorias también pueden engrosarse, lo que conduce a una enfermedad obstructiva de las vías respiratorias . A medida que el hígado y el bazo crecen con el tiempo, el abdomen puede distenderse , lo que hace que las hernias sean más visibles. Todas las articulaciones principales pueden verse afectadas por MPS II, lo que conduce a rigidez articular y movimiento limitado. La afectación progresiva de las articulaciones de los dedos y el pulgar da como resultado una disminución de la capacidad para recoger objetos pequeños. Los efectos en otras articulaciones, como las caderas y las rodillas, pueden hacer que caminar normalmente sea cada vez más difícil. Si se desarrolla el síndrome del túnel carpiano , puede producirse una disminución adicional de la función de la mano. Los propios huesos pueden verse afectados, lo que da como resultado una estatura baja. Además, en algunas personas que la padecen pueden encontrarse lesiones cutáneas de color marfil y con forma de guijarros en la parte superior de los brazos, las piernas y la espalda. Estas lesiones cutáneas se consideran patognomónicas de la enfermedad. Por último, el almacenamiento de GAG en el cerebro puede provocar un retraso en el desarrollo con la consiguiente discapacidad intelectual y pérdida progresiva de funciones. [ cita requerida ]
La edad de aparición de los síntomas y la presencia o ausencia de alteraciones del comportamiento son factores predictivos de la gravedad final de la enfermedad en pacientes muy jóvenes. Las alteraciones del comportamiento a menudo pueden imitar combinaciones de síntomas del trastorno por déficit de atención con hiperactividad , autismo , trastorno obsesivo compulsivo y/o trastorno del procesamiento sensorial , aunque la existencia y el nivel de los síntomas difieren en cada niño afectado. A menudo también incluyen una falta de un sentido apropiado del peligro y agresión. Los síntomas conductuales de MPS II generalmente preceden a la neurodegeneración y a menudo aumentan en gravedad hasta que las discapacidades mentales se vuelven más pronunciadas. [5] En el momento de la muerte, la mayoría de los niños con MPS II grave tienen discapacidades mentales graves y dependen completamente de sus cuidadores. [2]
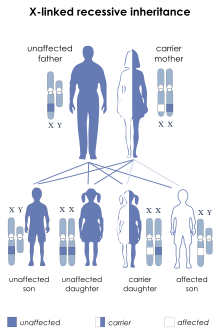
Dado que el síndrome de Hunter es un trastorno recesivo ligado al cromosoma X, afecta preferentemente a los pacientes varones. El gen IDS se encuentra en el cromosoma X y codifica una enzima llamada iduronato-2-sulfatasa (I2S). La falta de esta enzima provoca una acumulación de GAG, que causan los síntomas de la MPS II. [6]
Si una mujer hereda una copia del alelo mutante de MPS II, normalmente tendrá una copia normal del gen IDS que puede compensar el alelo mutante. Esto se conoce como portador genético . Sin embargo, un hombre que hereda un cromosoma X defectuoso normalmente no tiene otro cromosoma X para compensar el gen mutante. Por lo tanto, una mujer necesitaría heredar dos genes mutantes para desarrollar MPS II, mientras que un paciente masculino solo necesita heredar un gen mutante. Una mujer portadora puede verse afectada debido a la inactivación del cromosoma X , que es un proceso aleatorio. [ cita requerida ]
El cuerpo humano depende de una amplia gama de reacciones bioquímicas para llevar a cabo funciones esenciales. Una de estas funciones es la descomposición de grandes biomoléculas . La falla de este proceso es el problema subyacente en el síndrome de Hunter y otros trastornos de almacenamiento relacionados. [ cita requerida ]
La bioquímica del síndrome de Hunter está relacionada con un problema en una parte del tejido conectivo conocida como matriz extracelular , que está formada por una variedad de azúcares y proteínas . Ayuda a formar el marco arquitectónico del cuerpo. La matriz rodea las células del cuerpo en una red organizada y funciona como el pegamento que mantiene unidas las células del cuerpo. Una de las partes de la matriz extracelular es una molécula llamada proteoglicano . Al igual que muchos componentes del cuerpo, los proteoglicanos necesitan descomponerse y reemplazarse. Cuando el cuerpo descompone los proteoglicanos, uno de los productos resultantes son los mucopolisacáridos (GAG). [ cita requerida ]
En la MPS II, el problema se relaciona con la descomposición de dos GAG: dermatán sulfato y heparán sulfato . El primer paso en la descomposición del dermatán sulfato y el heparán sulfato requiere la enzima lisosomal iduronato-2-sulfatasa, o I2S. En las personas con MPS II, esta enzima está parcial o completamente inactiva. Como resultado, los GAG se acumulan en las células de todo el cuerpo, particularmente en los tejidos que contienen grandes cantidades de dermatán sulfato y heparán sulfato. La tasa de acumulación de GAG no es la misma para todas las personas con MPS II, lo que da lugar a un amplio espectro de problemas médicos. [ cita requerida ]
La primera prueba de detección de laboratorio para un trastorno de MPS es un análisis de orina para GAG. Los valores anormales indican que es probable que se trate de un trastorno de MPS. En ocasiones, el análisis de orina puede ser normal incluso si el niño realmente tiene un trastorno de MPS. El diagnóstico definitivo de MPS II se realiza midiendo la actividad de I2S en suero , glóbulos blancos o fibroblastos de una biopsia de piel . En algunas personas con MPS II, el análisis del gen I2S puede determinar la gravedad clínica. [ cita requerida ]
El diagnóstico prenatal se realiza de forma rutinaria midiendo la actividad enzimática I2S en el líquido amniótico o en el tejido de las vellosidades coriónicas . Si se sabe que una mutación específica se transmite en la familia, se pueden realizar pruebas genéticas moleculares prenatales. La secuenciación del ADN puede revelar si alguien es portador de la enfermedad. [2]
Debido a la amplia variedad de fenotipos, el tratamiento de este trastorno se determina específicamente para cada paciente. Hasta hace poco, no se disponía de una terapia eficaz para la MPS II, por lo que se recurría a los cuidados paliativos . Sin embargo, los avances recientes han dado lugar a medicamentos que pueden mejorar la supervivencia y el bienestar de las personas con MPS II. [ cita requerida ]
La idursulfasa , una forma purificada de la enzima lisosomal faltante, se sometió a un ensayo clínico en 2006 [6] y posteriormente fue aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos como tratamiento de reemplazo enzimático para MPS II. La idursulfasa beta, otro tratamiento de reemplazo enzimático, fue aprobada en Corea por el Ministerio de Seguridad de Alimentos y Medicamentos .
Se ha demostrado que los recientes avances en la terapia de reemplazo enzimático (ERT) con idursulfasa mejoran muchos signos y síntomas de la MPS II, especialmente si se inicia en las primeras etapas de la enfermedad. Después de la administración, puede transportarse a las células para descomponer los GAG, pero como el medicamento no puede atravesar la barrera hematoencefálica , no se espera que produzca una mejoría cognitiva en pacientes con síntomas graves del sistema nervioso central. Incluso con la ERT, es necesario el tratamiento de diversos problemas orgánicos por parte de una amplia variedad de especialistas médicos. [2]
El trasplante de médula ósea y el trasplante de células madre hematopoyéticas (TCMH) se han utilizado como tratamientos en algunos estudios. [7] [8] Si bien el trasplante ha proporcionado beneficios para muchos sistemas orgánicos, no se ha demostrado que mejore los síntomas neurológicos de la enfermedad. Si bien el TCMH ha demostrado ser prometedor en el tratamiento de otros trastornos de MPS, sus resultados hasta ahora han sido insatisfactorios en el tratamiento de MPS II. Se ha demostrado que la TRE conduce a mejores resultados en pacientes con MPS II. [2]
En febrero de 2019, los científicos médicos que trabajan con Sangamo Therapeutics , con sede en Richmond , California, anunciaron la primera terapia de edición genética humana "en el cuerpo" para alterar permanentemente el ADN , en un paciente con MPS II. [9] Los ensayos clínicos de Sangamo que involucran la edición genética utilizando nucleasa de dedo de zinc están en curso a partir de febrero de 2019. [10]
La aparición temprana de los síntomas está asociada a un peor pronóstico. En el caso de los niños que presentan síntomas entre los 2 y los 4 años, la muerte suele producirse entre los 15 y los 20 años. La causa de la muerte suele ser la aparición de complicaciones neurológicas, enfermedad obstructiva de las vías respiratorias e insuficiencia cardíaca. Si los pacientes presentan una afectación neurológica mínima, pueden sobrevivir hasta los 50 años o más. [1] [6]
Se estima que 2.000 personas padecen MPS II en todo el mundo, 500 de las cuales viven en Estados Unidos. [11]
Un estudio realizado en el Reino Unido indicó una incidencia entre los varones de alrededor de uno por cada 130.000 nacidos vivos varones. [12]
El síndrome recibe su nombre del médico Charles A. Hunter (1873-1955), quien lo describió por primera vez en 1917. [13] [14]
A principios de 2010, un ensayo clínico de fase I/II evaluó las inyecciones intratecales de una dosis más concentrada de idursulfasa que la formulación intravenosa utilizada en las infusiones de terapia de reemplazo enzimático, con la esperanza de prevenir el deterioro cognitivo asociado con la forma grave de la enfermedad. [15] Los resultados se informaron en octubre de 2013. [16] Un ensayo clínico de fase II/III comenzó en 2014. [17]
En 2017, un paciente de 44 años [18] con MPS II fue tratado con terapia génica en un intento de prevenir mayores daños por la enfermedad. Este es el primer caso de edición genética que se utiliza in vivo en humanos. [19] El estudio se amplió a seis pacientes en 2018. [20]
El 24 de julio de 2004, Andrew Wragg, de 38 años, de Worthing , West Sussex, Inglaterra, asfixió a su hijo Jacob, de 10 años, con una almohada, debido a las discapacidades del niño relacionadas con la MPS II. Wragg, especialista en seguridad militar , también afirmó que estaba bajo estrés después de regresar de la guerra de Irak . Negó haber asesinado a Jacob, pero se declaró culpable de homicidio por razón de capacidad disminuida. La jueza Anne Rafferty calificó el caso de "excepcional", condenó a Wragg a dos años de prisión por homicidio y luego suspendió su sentencia por dos años. Rafferty dijo que "no se ganaba nada" enviando a Wragg a prisión por el crimen. [21] [22] [23]