La fotofarmacología es un campo multidisciplinario emergente que combina la fotoquímica y la farmacología . [1] Basada en la capacidad de la luz para cambiar la farmacocinética y la farmacodinámica de las moléculas bioactivas, tiene como objetivo regular la actividad de los fármacos in vivo mediante el uso de la luz. [2] La modulación basada en la luz se logra incorporando fotointerruptores moleculares como el azobenceno y los diariletenos o fotojaulas como los compuestos o-nitrobencilo, cumarina y BODIPY en el farmacóforo. [3] Esta activación selectiva de las biomoléculas ayuda a prevenir o minimizar la actividad fuera del objetivo y los efectos secundarios sistémicos. Además, la luz, al ser el elemento regulador, ofrece ventajas adicionales, como la capacidad de administrarse con alta precisión espaciotemporal, toxicidad baja a insignificante y la capacidad de controlarse tanto cualitativa como cuantitativamente ajustando su longitud de onda e intensidad. [4]
Aunque la fotofarmacología es un campo relativamente nuevo, el concepto de utilizar la luz en aplicaciones terapéuticas se puso en práctica hace unas décadas. La terapia fotodinámica (PTD) es un protocolo bien establecido y practicado clínicamente en el que se utilizan fotosensibilizadores para producir oxígeno singlete para destruir células o tejidos enfermos o dañados. [2] La optogenética es otro método que se basa en la luz para controlar dinámicamente las funciones biológicas, especialmente las cerebrales y neuronales. [4] Aunque este enfoque ha demostrado ser útil como herramienta de investigación, su implementación clínica está limitada por el requisito de manipulación genética. Principalmente, estas dos técnicas sentaron las bases de la fotofarmacología. Hoy en día, es un campo en rápida evolución con diversas aplicaciones tanto en la investigación básica como en la medicina clínica que tiene el potencial de superar algunos de los desafíos que limitan el rango de aplicaciones de las otras terapias guiadas por luz.
Figura 1. Representación esquemática del mecanismo de (a) fotofarmacología, (b) terapia fotodinámica y (c) optogenética.
El descubrimiento de fotorreceptores naturales como las rodopsinas en el ojo inspiró a la comunidad de investigación biomédica y farmacológica a diseñar proteínas sensibles a la luz para aplicaciones terapéuticas. [2] El desarrollo de moléculas sintéticas fotoconmutables es el hito más significativo en la historia de los sistemas de suministro de luz. Los científicos continúan con sus esfuerzos para explorar nuevos fotoconmutadores y estrategias de suministro con un rendimiento mejorado para dirigirse a diferentes moléculas biológicas como canales iónicos, ácidos nucleicos y receptores enzimáticos. La investigación en fotofarmacología progresó de estudios in vitro a in vivo en un período de tiempo significativamente corto, produciendo resultados prometedores en ambas formas. Se están realizando ensayos clínicos para evaluar aún más la seguridad y eficacia de estas terapias fotofarmacológicas y validar su potencial como un enfoque innovador de suministro de fármacos.
Los fotointerruptores moleculares se utilizan en el campo de la fotofarmacología, donde la energía de una molécula se puede controlar de forma reversible con luz para lograr una resolución espacial y temporal de un efecto particular. Los fotointerruptores pueden funcionar mediante la fotoisomerización a través de la cual se utiliza luz para adaptar conformacionalmente una molécula a un sitio biológico, o mediante un efecto ambiental donde un factor externo como un efecto de disolvente o un enlace de hidrógeno puede permitir o extinguir selectivamente un estado emisivo dentro de una molécula. Para visualizar los procesos fotofísicos, una representación útil es el diagrama de Jablonski . Este es un diagrama que representa los niveles de energía electrónica y vibracional dentro de una molécula como niveles verticales y muestra las posibles vías de relajación a partir de estados excitados. Normalmente, el estado fundamental se denomina S 0 y se dibuja en la parte inferior de la figura con excitaciones vibracionales cercanas justo encima. Una absorción promoverá un electrón al estado S 1 en cualquier nivel de energía vibracional, o a un estado excitado de orden superior si la energía absorbida tiene suficiente magnitud. El estado excitado puede entonces sufrir una conversión interna, que es la relajación electrónica a un estado inferior con la misma energía vibracional o relajación vibracional dentro de un estado. Esto puede ser seguido por un cruce entre sistemas en el que el electrón sufre un cambio de espín o una descomposición radiativa o no radiativa de regreso al estado fundamental. [5]

Un ejemplo de un compuesto orgánico que sufre fotoisomerización es el azobenceno . La estructura es de dos anillos de fenilo unidos con un doble enlace N=N y es el compuesto arilo azo más simple. El azobenceno y sus derivados tienen dos bandas de absorbancia accesibles: el estado S 1 de una transición n-π* que puede ser excitada usando luz azul, y el estado S 2 de una transición π-π* que puede ser excitada usando luz ultravioleta. [6] El azobenceno y sus derivados tienen dos isómeros, trans y cis. El isómero trans, que tiene los anillos de fenilo en lados opuestos del doble enlace azo, es el isómero térmicamente preferido ya que hay menos distorsión estereoelectrónica y más deslocalización presente. Sin embargo, la excitación del isómero trans al estado S 2 facilita un cambio al isómero cis. La absorción S 1 está asociada con una conversión de regreso al isómero trans. De esta manera, el azobenceno y sus derivados pueden actuar como depósitos reversibles de energía al mantener una configuración forzada en el isómero cis. Las modificaciones de los sustituyentes del azobenceno permiten ajustar la energía de estas absorciones y, si se diseñan de manera que las dos bandas de absorción se superpongan, se puede utilizar una única longitud de onda de luz para alternarlas. Hay varios fotointerruptores similares que isomerizan entre las configuraciones E y Z a través de un grupo azo (por ejemplo, azobenceno y azopirazol) o un puente de etileno (por ejemplo, estilbeno y hemitioíndigo). [7]
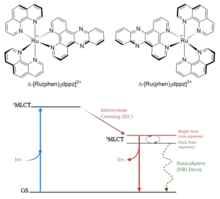
Alternativamente, los fotointerruptores pueden ser ellos mismos emisores y exhibir control ambiental sobre sus propiedades. Un ejemplo de ello es una clase de complejos de coordinación de polipiridilos de rutenio. Típicamente contienen dos ligandos bidentados de bipiridina o fenantrolina y un ligando bidentado de fenantrolina-fenazina extendido como dipirido[3,2-a:2,3-c]fenazina (dppz). [8] Estos complejos tienen un estado excitado de transferencia de carga de metal a ligando accesible ( 1 MLCT) que experimenta un rápido cruce entre sistemas a un estado 3 MLCT debido al fuerte acoplamiento de espín-órbita del centro de rutenio. Estos estados excitados se localizan en los nitrógenos de fenazina del ligando extendido, y la emisión ocurre desde el estado 3 MLCT. Las interacciones de enlaces de hidrógeno como la presencia de agua alrededor de estos átomos de nitrógeno estabilizan el estado 3 MLCT, apagando el proceso de emisión. De este modo, al controlar la presencia de un disolvente acuoso o polar prótico, se pueden “activar o desactivar” los comportamientos emisivos y se facilita la alternancia entre “estados brillantes” y “estados oscuros”. Este comportamiento de conmutación de la luz hace que estos y otros complejos similares sean de reciente interés en aplicaciones fotofarmacológicas como la terapia fotodinámica.
Como se mencionó anteriormente, la fotofarmacología se basa en el uso de fotointerruptores moleculares que se incorporan a la estructura de moléculas biológicamente activas, lo que permite controlar ópticamente su potencia. [7] Se introducen en la estructura de compuestos bioactivos mediante inserción, extensión o reemplazo bioisostérico. [7] Estas incorporaciones pueden respaldarse con consideraciones estructurales de la molécula o análisis SAR (relación estructura-actividad) para determinar la posición óptima. [7] Algunos ejemplos de moléculas fotoconmutables que se utilizan comúnmente en fotofarmacología son los azobencenos, los diariletenos y las fotojaulas. [9]
Los azobencenos son una clase de moléculas fotoconmutables y se utilizan en aplicaciones fotofarmacológicas por su fotoisomerización reversible, como se describe en la sección anterior. Un ejemplo de una molécula fotoconmutable que utiliza azobenceno es el fototrexato. El fototrexato es un inhibidor de la dihidrofolato reductasa humana y es un análogo del metotrexato , un agente quimioterapéutico. [10] Cuando está en su forma cis fotoactiva, se ha demostrado que el fototrexato es un potente antifolato y es relativamente inactivo cuando está en la forma trans. [10] La azologización, o incorporación de azobenceno, del metotrexato permite controlar la actividad citotóxica y se considera un paso adelante en el desarrollo de fármacos anticancerígenos dirigidos con eficacia localizada. [10]
Los fotointerruptores de diarileteno tienen reacciones de ciclización y ciclorreversión reversibles que son fotoinducidas. [11] Son una clase de compuestos que tienen grupos funcionales aromáticos unidos a cada extremo de un doble enlace carbono-carbono. Un ejemplo de esta clase de molécula que se utiliza en fotofarmacología es el estilbeno . Bajo la influencia de la luz, el estilbeno cambia entre sus dos isómeros (E y Z).
Figura 4. Figura que muestra las isomerizaciones de estilbeno bajo la luz de E a Z.
Se ha demostrado que los diariletenos tienen algunas ventajas sobre los interruptores azobencenos más investigados, como la irreversibilidad térmica, la alta eficiencia de la fotoconmutación, la estabilidad celular favorable y la baja toxicidad. [11] Se ha demostrado que los diariletenos también son prometedores en campos distintos a la fotofarmacología. Estos campos incluyen el almacenamiento de datos ópticos, los dispositivos optoelectrónicos, el autoensamblaje supramolecular y la lucha contra la falsificación. [11]
Una clase de sustancias conocidas como fotojaulas contienen “grupos fotosensibles, también conocidos como 'grupos protectores fotorremovibles', de los cuales se liberan las sustancias objetivo tras la exposición a longitudes de onda de luz específicas”. [12] Los grupos fotosensibles protegen física y químicamente el objetivo de ser liberado hasta que la molécula experimenta fotorreacción. [12] Debido a estas interacciones con la luz, son moléculas de uso común en fotofarmacología. Más recientemente, han desempeñado un papel importante en la quimioterapia fotoactivada (PACT). En PACT, las fotojaulas utilizan un grupo protector fotorremovible que protege a los fármacos citotóxicos hasta que el enlace se escinde a través de la interacción con la luz y se libera el fármaco citotóxico. [13] Algunas fotojaulas conocidas incluyen “derivados de o-nitrobencilo, derivados de cumarina, BODIPY, derivados de xanteno, derivados de quinona y diarilenos”. [12] Sin embargo, existen limitaciones con el uso de fotojaulas en aplicaciones clínicas, ya que no hay muchos PPG que se puedan usar in vivo. Esto se debe a que los conjugados de carga útil PPG deben tener una solubilidad aceptable y una inercia biológica para la biocompatibilidad y la necesidad de una liberación eficiente por encima de los 600 nm. [13]
Figura 5. Ejemplo de un sistema de liberación de fotojaula activado por NIR [14]
La fotofarmacología, el uso de la luz para controlar la actividad de los fármacos, ha surgido como un enfoque prometedor para la administración y la terapia de fármacos. Al aprovechar el poder de la luz, los investigadores pueden lograr un control preciso sobre la liberación y activación de los fármacos, lo que ofrece nuevas posibilidades para tratamientos personalizados y dirigidos. En esta subsección, exploramos la aplicación de la fotofarmacología en la administración de fármacos, centrándonos en los avances recientes y las posibles aplicaciones clínicas. En este estudio [15], los investigadores diseñaron inhibidores de HDAC que se pueden activar o desactivar con luz, lo que proporciona un control terapéutico preciso. Este enfoque podría reducir los efectos secundarios de la quimioterapia tradicional al dirigir los inhibidores a áreas corporales específicas, lo que podría conducir a tratamientos contra el cáncer más efectivos y personalizados.

En este estudio, [16] los investigadores desarrollaron una estrategia para unir un grupo fotoconmutable a un antibiótico común, la ciprofloxacina. Al unir el grupo fotoconmutable, los investigadores pueden controlar la actividad de la ciprofloxacina con luz. Este enfoque podría conducir potencialmente a nuevas formas de tratar las infecciones bacterianas, con la capacidad de activar y desactivar la actividad del antibiótico según sea necesario. En este artículo [17] se desarrolla un protocolo in vitro para probar diferentes longitudes de onda de luz en líneas celulares de cáncer humano, y se descubre que la luz azul inhibe el crecimiento celular de manera más efectiva. Esto sugiere que la fotofarmacología podría ofrecer nuevas opciones de tratamiento del cáncer al dirigir longitudes de onda de luz específicas para modular la actividad del fármaco en las células tumorales. Otra aplicación de la fotofarmacología [18] es el desarrollo de un fotoCORM luminiscente injertado en carboximetilquitosano, que, cuando se expone a la luz, libera monóxido de carbono (CO) para inducir la muerte apoptótica en células de cáncer colorrectal, lo que demuestra un control preciso sobre la liberación de CO para la terapia dirigida contra el cáncer. Los investigadores desarrollaron una caja de herramientas de antagonistas fotoconmutables que pueden interactuar con GPCR, una clase de proteínas involucradas en varios procesos celulares. [19] Al usar luz para cambiar la actividad de estos antagonistas, los investigadores pueden controlar la interacción entre los antagonistas y GPCR en tiempo real. Este enfoque permite una modulación precisa de la actividad de GPCR, lo que podría conducir a nuevos conocimientos sobre las vías de señalización celular y posibles aplicaciones terapéuticas. En otra aplicación [20] al usar luz para controlar el ensamblaje de nanoporos, los investigadores pueden potencialmente regular el flujo de iones o moléculas a través de estos nanoporos. Este enfoque podría tener aplicaciones en varios campos, incluidos la detección, la administración de fármacos y la nanotecnología. En este artículo [21] han utilizado la fotofarmacología para controlar la actividad de los fármacos; las fibras multifuncionales en el estudio entregan luz y fármacos a áreas corporales específicas. Las fibras implantadas activan fármacos sensibles a la luz, alterando su estructura y ofreciendo una administración precisa de fármacos para afecciones que requieren un momento o una dosis exactos. En otro estudio, [22] se diseñaron ligandos para cambiar su modo de unión al ADN G-quadruplex tras la exposición a la luz visible. Este método podría modular potencialmente la actividad del ADN G-quadruplex, crucial en la expresión genética y el mantenimiento de los telómeros, ofreciendo nuevas vías terapéuticas, en particular en el tratamiento del cáncer. El estudio subraya la promesa de la fotofarmacología en la focalización de estructuras específicas del ADN, lo que sugiere que el ADN G-quadruplex es un objetivo viable para futuras intervenciones fotofarmacológicas. Este estudio [23]Se desarrollaron conjugados fotoactivables de anticuerpo-photoCORM dirigidos a células de cáncer de ovario humano, que liberan CO tras la exposición a la luz para disminuir la viabilidad celular. Este enfoque ofrece una orientación precisa a las células cancerosas al tiempo que minimiza el daño al tejido sano, lo que demuestra el potencial de la fotofarmacología en la terapia del cáncer. En este artículo, [24] se ha desarrollado un compuesto fotoactivable que se une a la proteína CRY1 y modula su actividad, regulando el reloj circadiano de los mamíferos. Al usar la luz para controlar la actividad del compuesto, los investigadores pueden tratar potencialmente los trastornos del ritmo circadiano y las condiciones de salud relacionadas modulando la función de CRY1. La fotofarmacología implica el uso de la luz para controlar la actividad de los fármacos. En otra aplicación [25], los investigadores utilizan la fotofarmacología para controlar la liberación de fármacos y se centran en un fármaco que interactúa con la tubulina, visualizando su liberación en tiempo real con cristalografía en serie resuelta en el tiempo. Esta técnica ofrece información sobre las interacciones fármaco-tubulina y demuestra el potencial para diseñar fármacos con acciones precisas.
El futuro de la fotofarmacología es muy prometedor. Tiene el potencial de revolucionar la farmacoterapia convencional, ofreciendo nuevas vías para la medicina de precisión, el tratamiento de trastornos neurológicos y en el campo de la oncología y la oftalmología . [1] Además, es prometedora para el campo de la medicina regenerativa , donde los fotointerruptores se pueden utilizar para modular la actividad de las vías de señalización para la reparación y regeneración de tejidos específicos. [3]
La fotofarmacología seguirá creciendo y expandiéndose con los nuevos descubrimientos y avances que se produzcan en otros campos relacionados, como la química sintética, la biología, la nanotecnología, la farmacología y la bioingeniería. Si bien el potencial de la fotofarmacología es enorme, existen algunos desafíos que deben abordarse para convertirla en una realidad clínica. Uno de esos desafíos es el desarrollo de fotointerruptores estables y biocompatibles que sean selectivos para sus receptores objetivo sin actividad cruzada. [2] Es particularmente importante que estos fotointerruptores tengan sus bandas de absorbancia dentro del rango de longitud de onda de 650 nm a 900 nm. [2] Por lo tanto, se requiere un diseño molecular óptimo de los fotointerruptores para lograr las características mencionadas anteriormente y el nivel de rendimiento deseado. En la actualidad, la fotofarmacología utiliza un enfoque de diseño de fármacos racional basado en el estudio de la relación estructura-actividad; sin embargo, una evaluación fenotípica de los fármacos fotointerruptores también podría ser beneficiosa.
Para lograr un buen control espacio-temporal de la actividad de los fármacos, debe existir una diferencia significativa entre la actividad de los isómeros. Sin embargo, la comprensión de los cambios estructurales durante los efectos biológicos inducidos por la fotoconmutación es limitada. Esta escasez de conocimiento también es un desafío para el crecimiento de este campo, ya que dificulta la optimización de la actividad y la potencia de los isómeros para obtener los resultados esperados durante las aplicaciones. [3]
Otro obstáculo, el mayor desafío en fotofarmacología es encontrar formas apropiadas y efectivas de hacer llegar la luz a los tejidos profundos del cuerpo y a los tejidos evitando problemas como la dispersión y la absorción. Se han intentado varias estrategias a este respecto, una de ellas es el desarrollo de ligandos fotoconmutables que responden a longitudes de onda que penetran en los tejidos profundos, como la luz roja o infrarroja. Además, algunos estudios preclínicos recientes han impulsado el desarrollo de dispositivos inalámbricos, compactos o inyectables y controlables de forma remota capaces de hacer llegar la luz a los tejidos neuronales con un daño mínimo. [26] Existen nuevos sistemas optofluídicos que pueden regular simultáneamente tanto la administración de fármacos como la actividad de la luz en sitios específicos. Aunque la administración externa de luz es el método más preferido, el uso de fuentes de luz exógenas internas, como compuestos luminiscentes, donde la luz se administraría directamente en el sitio de acción, podría evitar los problemas relacionados con la penetración de la luz y también mejorar el grado de selectividad. Además, esto crea la oportunidad de utilizar la fotofarmacología como un enfoque teranóstico que combina la administración dirigida de fármacos y la obtención de imágenes moleculares. [2]