
A diferencia del potencial de acción en las células del músculo esquelético , el potencial de acción cardíaco no se inicia por la actividad nerviosa. En cambio, surge de un grupo de células especializadas conocidas como células marcapasos , que tienen la capacidad de generar potenciales de acción automáticamente. En los corazones sanos, estas células forman el marcapasos cardíaco y se encuentran en el nódulo sinoauricular en la aurícula derecha . Producen aproximadamente entre 60 y 100 potenciales de acción por minuto. El potencial de acción pasa a lo largo de la membrana celular haciendo que la célula se contraiga, por lo tanto, la actividad del nódulo sinoauricular da como resultado una frecuencia cardíaca en reposo de aproximadamente 60 a 100 latidos por minuto. Todas las células del músculo cardíaco están conectadas eléctricamente entre sí, por discos intercalados que permiten que el potencial de acción pase de una célula a la siguiente. [1] [2] Esto significa que todas las células auriculares pueden contraerse juntas, y luego todas las células ventriculares.

La dependencia de la frecuencia del potencial de acción es una propiedad fundamental de las células cardíacas y sus alteraciones pueden provocar enfermedades cardíacas graves, como arritmias cardíacas y, en ocasiones, muerte súbita. [3] La actividad del potencial de acción en el corazón se puede registrar para producir un electrocardiograma (ECG). Se trata de una serie de picos ascendentes y descendentes (etiquetados como P, Q, R, S y T) que representan la despolarización (voltaje que se vuelve más positivo) y la repolarización (voltaje que se vuelve más negativo) del potencial de acción en las aurículas y los ventrículos . [4]
De manera similar al músculo esquelético, el potencial de membrana en reposo (voltaje cuando la célula no está excitada eléctricamente) de las células ventriculares es de alrededor de -90 milivoltios (mV; 1 mV = 0,001 V), es decir, el interior de la membrana es más negativo que el exterior. Los principales iones que se encuentran fuera de la célula en reposo son sodio (Na + ) y cloruro (Cl − ), mientras que dentro de la célula es principalmente potasio (K + ). [6]
El potencial de acción comienza con el voltaje volviéndose más positivo; esto se conoce como despolarización y se debe principalmente a la apertura de los canales de sodio que permiten que el Na + fluya hacia la célula. Después de un retraso (conocido como período refractario absoluto ), el potencial de acción termina a medida que se abren los canales de potasio, lo que permite que el K + salga de la célula y hace que el potencial de membrana vuelva a ser negativo, esto se conoce como repolarización . Otro ion importante es el calcio (Ca 2+ ) , que se puede encontrar dentro de la célula en el retículo sarcoplásmico (SR) donde se almacena el calcio, y también se encuentra fuera de la célula. La liberación de Ca 2+ del SR, a través de un proceso llamado liberación de calcio inducida por calcio , es vital para la fase de meseta del potencial de acción (ver fase 2, a continuación) y es un paso fundamental en el acoplamiento excitación-contracción cardíaca . [7]
Existen importantes diferencias fisiológicas entre las células marcapasos del nódulo sinoauricular , que generan espontáneamente el potencial de acción cardíaco y aquellas células no marcapasos que simplemente lo conducen, como los miocitos ventriculares ). Las diferencias específicas en los tipos de canales iónicos expresados y los mecanismos por los cuales se activan resultan en diferencias en la configuración de la forma de onda del potencial de acción, como se muestra en la figura 2.
La automaticidad cardíaca, también conocida como autorritmicidad , es la propiedad de las células musculares conductoras especializadas del corazón para generar potenciales de acción cardíaca espontáneos. [8] [9] La automaticidad puede ser normal o anormal, causada por cambios característicos temporales del canal iónico , como el uso de ciertos medicamentos, o en el caso de la automaticidad anormal, los cambios son en el entorno electrotónico , causados, por ejemplo, por un infarto de miocardio . [10]

El modelo estándar utilizado para comprender el potencial de acción cardíaco es el del miocito ventricular. A continuación se describen las cinco fases del potencial de acción del miocito ventricular, con referencia también al potencial de acción del SAN.

En el miocito ventricular, la fase 4 ocurre cuando la célula está en reposo, en un período conocido como diástole . En la célula estándar sin marcapasos, el voltaje durante esta fase es más o menos constante, aproximadamente a -90 mV. [11] El potencial de membrana en reposo resulta del flujo de iones que han entrado en la célula (por ejemplo, sodio y calcio), el flujo de iones que han salido de la célula (por ejemplo, potasio, cloruro y bicarbonato), así como el flujo de iones generados por las diferentes bombas de membrana, que están perfectamente equilibrados.
La actividad de estas bombas tiene dos propósitos. El primero es mantener la existencia del potencial de membrana en reposo contrarrestando la despolarización debida a la fuga de iones que no se encuentran en equilibrio electroquímico (por ejemplo, sodio y calcio). El hecho de que estos iones no se encuentren en equilibrio es la razón de la existencia de un gradiente eléctrico, ya que representan un desplazamiento neto de cargas a través de la membrana, que no pueden volver a entrar inmediatamente en la célula para restablecer el equilibrio eléctrico. Por lo tanto, su lenta reentrada en la célula debe ser contrarrestada o la célula perdería lentamente su potencial de membrana.
El segundo propósito, íntimamente ligado al primero, es mantener la concentración intracelular más o menos constante, y en este caso restablecer los gradientes químicos originales, es decir, forzar al sodio y al calcio que previamente fluían hacia dentro de la célula a salir de ella, y al potasio que previamente fluía fuera de la célula a volver a entrar en ella (aunque como el potasio está mayoritariamente en el equilibrio electroquímico, su gradiente químico se reequilibrará naturalmente en sentido opuesto al gradiente eléctrico, sin necesidad de un mecanismo de transporte activo).
Por ejemplo, los iones de sodio (Na + ) y potasio (K + ) se mantienen gracias a la bomba de sodio-potasio , que utiliza energía (en forma de trifosfato de adenosina (ATP) ) para sacar tres Na + de la célula y sacar dos K + de ella. Otro ejemplo es el intercambiador de sodio-calcio , que saca un Ca2 + de la célula por tres Na + que entran en ella. [12]
Durante esta fase, la membrana es más permeable al K + , que puede entrar o salir de la célula a través de canales de fuga, incluido el canal de potasio rectificador interno. [13] Por lo tanto, el potencial de membrana en reposo es en su mayoría igual al potencial de equilibrio de K + y se puede calcular utilizando la ecuación de voltaje de Goldman-Hodgkin-Katz .
Sin embargo, las células marcapasos nunca están en reposo. En estas células, la fase 4 también se conoce como potencial de marcapasos . Durante esta fase, el potencial de membrana se vuelve lentamente más positivo, hasta alcanzar un valor establecido (alrededor de -40 mV; conocido como potencial umbral) o hasta que se despolariza por otro potencial de acción, proveniente de una célula vecina.
Se cree que el potencial marcapasos se debe a un grupo de canales, denominados canales HCN (Hyperpolarization-activated cyclic nucleotide-gated) . Estos canales se abren a voltajes muy negativos (es decir, inmediatamente después de la fase 3 del potencial de acción anterior; véase más adelante) y permiten el paso tanto de K + como de Na + a la célula. Debido a su propiedad inusual de ser activados por potenciales de membrana muy negativos, el movimiento de iones a través de los canales HCN se conoce como corriente extraña (véase más adelante). [14]
Otra hipótesis sobre el potencial marcapasos es el "reloj de calcio". El calcio se libera desde el retículo sarcoplásmico dentro de la célula. Este calcio aumenta la activación del intercambiador de sodio-calcio, lo que da como resultado un aumento del potencial de membrana (ya que una carga +3 ingresa a la célula (por el 3Na + ) pero solo una carga +2 sale de la célula (por el Ca2 + ), por lo tanto, hay una carga neta de +1 que ingresa a la célula). Luego, este calcio se bombea nuevamente hacia la célula y hacia el SR a través de bombas de calcio (incluida la SERCA ). [15]
Esta fase consiste en un cambio rápido y positivo en el voltaje a través de la membrana celular ( despolarización ) que dura menos de 2 ms en las células ventriculares y 10-20 ms en las células SAN . [16] Esto ocurre debido a un flujo neto de carga positiva hacia la célula.
En las células no marcapasos (es decir, las células ventriculares), esto se produce predominantemente por la activación de los canales de Na + , lo que aumenta la conductancia de membrana (flujo) de Na + (g Na ). Estos canales se activan cuando llega un potencial de acción desde una célula vecina, a través de uniones gap . Cuando esto sucede, el voltaje dentro de la célula aumenta ligeramente. Si este voltaje aumentado alcanza el potencial umbral (aproximadamente −70 mV) hace que los canales de Na + se abran. Esto produce una mayor afluencia de sodio en la célula, aumentando rápidamente aún más el voltaje hasta alrededor de +50 mV, [6] es decir, hacia el potencial de equilibrio de Na + . Sin embargo, si el estímulo inicial no es lo suficientemente fuerte y no se alcanza el potencial umbral, los canales rápidos de sodio no se activarán y no se producirá un potencial de acción; esto se conoce como la ley del todo o nada . [17] [18] La afluencia de iones de calcio (Ca 2+ ) a través de los canales de calcio de tipo L también constituye una parte menor del efecto de despolarización. [19] La pendiente de la fase 0 en la forma de onda del potencial de acción (ver figura 2) representa la tasa máxima de cambio de voltaje del potencial de acción cardíaco y se conoce como dV/dt máx .
Sin embargo, en las células marcapasos (por ejemplo , las células del nódulo sinoauricular ), el aumento del voltaje de la membrana se debe principalmente a la activación de los canales de calcio de tipo L. Estos canales también se activan por un aumento del voltaje, pero esta vez se debe al potencial de marcapasos (fase 4) o a un potencial de acción entrante. Los canales de calcio de tipo L se activan más lentamente que los canales de sodio, por lo tanto, la pendiente de despolarización en la forma de onda del potencial de acción del marcapasos es menos pronunciada que en la forma de onda del potencial de acción sin marcapasos. [11] [20]
Esta fase comienza con la rápida inactivación de los canales de Na + por la compuerta interna (compuerta de inactivación), lo que reduce el movimiento de sodio hacia el interior de la célula. Al mismo tiempo, los canales de potasio (llamados I a 1 ) se abren y cierran rápidamente, lo que permite un breve flujo de iones de potasio hacia el exterior de la célula, lo que hace que el potencial de membrana sea ligeramente más negativo. Esto se conoce como una "muesca" en la forma de onda del potencial de acción. [11]
No hay una fase 1 obvia presente en las células marcapasos.
Esta fase también se conoce como fase de "meseta" debido a que el potencial de membrana permanece casi constante, a medida que la membrana comienza a repolarizarse lentamente. Esto se debe al equilibrio casi total de carga que entra y sale de la célula. Durante esta fase, los canales de potasio rectificadores retardados (I ks ) permiten que el potasio salga de la célula, mientras que los canales de calcio de tipo L (activados por la entrada de sodio durante la fase 0) permiten el movimiento de iones de calcio hacia el interior de la célula. Estos iones de calcio se unen a más canales de calcio (llamados receptores de rianodina) ubicados en el retículo sarcoplásmico dentro de la célula y los abren, lo que permite el flujo de calcio fuera del retículo sarcoplásmico. Estos iones de calcio son responsables de la contracción del corazón.
El calcio también activa los canales de cloruro llamados I a 2 , que permiten que el Cl − entre en la célula. El aumento de la concentración de calcio en la célula también aumenta la actividad de los intercambiadores de sodio-calcio, mientras que el aumento de la concentración de sodio (debido a la despolarización de la fase 0) aumenta la actividad de las bombas de sodio-potasio. El movimiento de todos estos iones hace que el potencial de membrana permanezca relativamente constante, con la salida de K + , la entrada de Cl −, así como las bombas de Na + /K + que contribuyen a la repolarización y la entrada de Ca 2+ , así como los intercambiadores de Na + /Ca 2+ que contribuyen a la despolarización. [21] [11] Esta fase es responsable de la gran duración del potencial de acción y es importante para prevenir el latido cardíaco irregular (arritmia cardíaca).
No hay fase de meseta presente en los potenciales de acción del marcapasos.
Durante la fase 3 (la fase de "repolarización rápida") del potencial de acción, los canales de Ca 2+ de tipo L se cierran, mientras que los canales de K + rectificadores retardados lentos (I Ks ) permanecen abiertos a medida que se abren más canales de fuga de potasio. Esto asegura una corriente positiva neta de salida, correspondiente al cambio negativo en el potencial de membrana , lo que permite que se abran más tipos de canales de K + . Estos son principalmente los canales de K + rectificadores retardados rápidos (I Kr ) y la corriente de K + rectificadora de entrada , I K1 . Esta corriente positiva neta de salida (igual a la pérdida de carga positiva de la célula) hace que la célula se repolarice. Los canales de K + rectificadores retardados se cierran cuando el potencial de membrana se restaura a aproximadamente -85 a -90 mV, mientras que I K1 permanece conduciendo durante toda la fase 4, lo que ayuda a establecer el potencial de membrana en reposo [22]
Las bombas iónicas, como el intercambiador de sodio-calcio y la bomba de sodio-potasio, que se han analizado anteriormente , restablecen las concentraciones de iones a los estados de equilibrio previos al potencial de acción. Esto significa que se bombea el calcio intracelular, que era responsable de la contracción de los miocitos cardíacos. Una vez que se pierde, la contracción se detiene y los músculos del corazón se relajan.
En el nódulo sinoatrial, esta fase también se debe al cierre de los canales de calcio tipo L, impidiendo el flujo entrante de Ca 2+ y la apertura de los canales de potasio rectificadores retardados rápidos (I Kr ). [23]
Las células cardíacas tienen dos períodos refractarios , el primero desde el comienzo de la fase 0 hasta la mitad de la fase 3, conocido como período refractario absoluto, durante el cual es imposible que la célula produzca otro potencial de acción. A este le sigue inmediatamente, hasta el final de la fase 3, un período refractario relativo, durante el cual se requiere un estímulo más fuerte de lo habitual para producir otro potencial de acción. [24] [25]
Estos dos períodos refractarios son causados por cambios en los estados de los canales de sodio y potasio . La rápida despolarización de la célula, durante la fase 0, hace que el potencial de membrana se acerque al potencial de equilibrio del sodio (es decir, el potencial de membrana en el que el sodio ya no entra ni sale de la célula). A medida que el potencial de membrana se vuelve más positivo, los canales de sodio se cierran y bloquean, lo que se conoce como estado "inactivado". Durante este estado, los canales no se pueden abrir independientemente de la fuerza del estímulo excitatorio, lo que da lugar al período refractario absoluto. El período refractario relativo se debe a la fuga de iones de potasio, lo que hace que el potencial de membrana sea más negativo (es decir, está hiperpolarizado), esto restablece los canales de sodio; abre la compuerta de inactivación, pero sigue dejando el canal cerrado. Debido a que algunos de los canales de iones de sodio dependientes de voltaje se han recuperado y los canales de iones de potasio dependientes de voltaje permanecen abiertos, es posible iniciar otro potencial de acción si el estímulo es más fuerte que un estímulo que puede disparar un potencial de acción cuando la membrana está en reposo. [26]
Las uniones en hendidura permiten que el potencial de acción se transfiera de una célula a la siguiente (se dice que acoplan eléctricamente las células cardíacas vecinas ). Están hechas de la familia de proteínas conexinas , que forman un poro a través del cual pueden pasar iones (incluidos Na + , Ca 2+ y K + ). Como el potasio es más alto dentro de la célula, es principalmente potasio el que pasa a través. Este aumento de potasio en la célula vecina hace que el potencial de membrana aumente ligeramente, activando los canales de sodio e iniciando un potencial de acción en esta célula. (Un breve eflujo impulsado por gradiente químico de Na + a través del conexón en la despolarización máxima causa la conducción de la despolarización de célula a célula, no el potasio). [27] Estas conexiones permiten la conducción rápida del potencial de acción en todo el corazón y son responsables de permitir que todas las células de las aurículas se contraigan juntas, así como todas las células de los ventrículos. [28] La contracción descoordinada de los músculos del corazón es la base de la arritmia y la insuficiencia cardíaca. [29]
Los canales iónicos son proteínas que cambian de forma en respuesta a diferentes estímulos para permitir o impedir el movimiento de iones específicos a través de una membrana. Se dice que son selectivamente permeables. Los estímulos, que pueden provenir del exterior de la célula o del interior de la misma, pueden incluir la unión de una molécula específica a un receptor en el canal (también conocidos como canales iónicos controlados por ligando ) o un cambio en el potencial de membrana alrededor del canal, detectado por un sensor (también conocido como canales iónicos controlados por voltaje ) y puede actuar para abrir o cerrar el canal. El poro formado por un canal iónico es acuoso (lleno de agua) y permite que el ion viaje rápidamente a través de la membrana. [33] Los canales iónicos pueden ser selectivos para iones específicos, por lo que existen canales específicos de Na + , K + , Ca 2+ y Cl − . También pueden ser específicos para una determinada carga de iones (es decir, positiva o negativa). [34]
Cada canal está codificado por un conjunto de instrucciones de ADN que le indican a la célula cómo fabricarlo. Estas instrucciones se conocen como genes . La Figura 3 muestra los canales iónicos importantes que intervienen en el potencial de acción cardíaco, la corriente (iones) que fluye a través de los canales, sus principales subunidades proteicas (bloques constructores del canal), algunos de sus genes controladores que codifican su estructura y las fases que están activas durante el potencial de acción cardíaco. A continuación se describen brevemente algunos de los canales iónicos más importantes que intervienen en el potencial de acción cardíaco.
Los canales activados por nucleótidos cíclicos (canales HCN) se encuentran principalmente en las células marcapasos; estos canales se activan a potenciales de membrana muy negativos y permiten el paso de Na + y K + a la célula (que es un movimiento conocido como corriente extraña, If ) . Estos canales catiónicos (iones cargados positivamente) poco selectivos conducen más corriente a medida que el potencial de membrana se vuelve más negativo (hiperpolarizado). La actividad de estos canales en las células SAN hace que el potencial de membrana se despolarice lentamente y, por lo tanto, se cree que son responsables del potencial marcapasos. Los nervios simpáticos afectan directamente a estos canales, lo que resulta en un aumento de la frecuencia cardíaca (ver a continuación). [35] [14]
Estos canales de sodio dependen del voltaje y se abren rápidamente debido a la despolarización de la membrana, que generalmente ocurre desde las células vecinas, a través de uniones en hendidura. Permiten un flujo rápido de sodio hacia la célula, despolarizando la membrana por completo e iniciando un potencial de acción. A medida que aumenta el potencial de membrana, estos canales se cierran y se bloquean (se vuelven inactivos). Debido a la rápida afluencia de iones de sodio (fase 0 pronunciada en la forma de onda del potencial de acción), la activación e inactivación de estos canales ocurre casi exactamente al mismo tiempo. Durante el estado de inactivación, el Na + no puede pasar a través de ellos (período refractario absoluto). Sin embargo, comienzan a recuperarse de la inactivación a medida que el potencial de membrana se vuelve más negativo (período refractario relativo).
Los dos tipos principales de canales de potasio en las células cardíacas son los rectificadores internos y los canales de potasio dependientes del voltaje. [ cita requerida ]
Los canales de potasio rectificadores de entrada (K ir) favorecen el flujo de K + hacia la célula. Sin embargo, este flujo de entrada de potasio es mayor cuando el potencial de membrana es más negativo que el potencial de equilibrio para K + (~ -90 mV). A medida que el potencial de membrana se vuelve más positivo (es decir, durante la estimulación celular desde una célula vecina), el flujo de potasio hacia la célula a través del K ir disminuye. Por lo tanto, el K ir es responsable de mantener el potencial de membrana en reposo e iniciar la fase de despolarización. Sin embargo, a medida que el potencial de membrana continúa volviéndose más positivo, el canal comienza a permitir el paso de K + fuera de la célula. Este flujo de salida de iones de potasio en los potenciales de membrana más positivos significa que el K ir también puede ayudar a las etapas finales de la repolarización. [36] [37]
Los canales de potasio dependientes del voltaje (K v ) se activan por despolarización. Las corrientes producidas por estos canales incluyen la corriente transitoria de salida de potasio I to1 . Esta corriente tiene dos componentes. Ambos componentes se activan rápidamente, pero I to,fast se inactiva más rápidamente que I to, slow . Estas corrientes contribuyen a la fase de repolarización temprana (fase 1) del potencial de acción. [ cita requerida ]
Otra forma de canales de potasio dependientes del voltaje son los canales de potasio rectificadores retardados. Estos canales transportan corrientes de potasio que son responsables de la fase de meseta del potencial de acción y se denominan según la velocidad a la que se activan: activación lenta I Ks , activación rápida I Kr y activación ultrarrápida I Kur . [38]
Existen dos canales de calcio dependientes del voltaje en el interior del músculo cardíaco: los canales de calcio de tipo L (L significa de larga duración) y los canales de calcio de tipo T (T significa transitorios, es decir, de corta duración). Los canales de tipo L son más comunes y están más densamente poblados en la membrana del túbulo T de las células ventriculares, mientras que los canales de tipo T se encuentran principalmente en las células auriculares y marcapasos , pero en menor grado que los canales de tipo L. [ cita requerida ]
Estos canales responden a los cambios de voltaje a través de la membrana de manera diferente: los canales de tipo L se activan con potenciales de membrana más positivos, tardan más en abrirse y permanecen abiertos durante más tiempo que los canales de tipo T. Esto significa que los canales de tipo T contribuyen más a la despolarización (fase 0), mientras que los canales de tipo L contribuyen a la meseta (fase 2). [39]

En el sistema de conducción del corazón, la actividad eléctrica que se origina en el nódulo sinoauricular (NAS) se propaga a través de la red de His - Purkinje , la vía de conducción más rápida dentro del corazón. La señal eléctrica viaja desde el nódulo sinoauricular, que estimula la contracción de las aurículas , hasta el nódulo auriculoventricular (NAV) , que ralentiza la conducción del potencial de acción desde las aurículas hasta los ventrículos . Este retraso permite que los ventrículos se llenen completamente de sangre antes de la contracción. Luego, la señal pasa a través de un haz de fibras llamado haz de His , ubicado entre los ventrículos, y luego a las fibras de Purkinje en la parte inferior (ápice) del corazón, lo que provoca la contracción ventricular. [ cita requerida ]
Además del SAN, el AVN y las fibras de Purkinje también tienen actividad de marcapasos y, por lo tanto, pueden generar espontáneamente un potencial de acción. Sin embargo, estas células generalmente no se despolarizan espontáneamente, simplemente porque la producción de potencial de acción en el SAN es más rápida. Esto significa que antes de que el AVN o las fibras de Purkinje alcancen el potencial umbral para un potencial de acción, se despolarizan por el impulso entrante del SAN [40] . Esto se llama "supresión de sobremarcha". [41] La actividad de marcapasos de estas células es vital, ya que significa que si el SAN fallara, entonces el corazón podría seguir latiendo, aunque a una frecuencia más baja (AVN = 40-60 latidos por minuto, fibras de Purkinje = 20-40 latidos por minuto). Estos marcapasos mantendrán vivo al paciente hasta que llegue el equipo de emergencia. [ cita requerida ]
Un ejemplo de contracción ventricular prematura es el síndrome del corazón atlético clásico . El entrenamiento sostenido de los atletas provoca una adaptación cardíaca en la que la frecuencia cardíaca en reposo del SAN es menor (a veces alrededor de 40 latidos por minuto). Esto puede provocar un bloqueo auriculoventricular , en el que la señal del SAN se ve afectada en su camino hacia los ventrículos. Esto conduce a contracciones descoordinadas entre las aurículas y los ventrículos, sin el retraso correcto entre ellas y, en casos graves, puede provocar muerte súbita. [42]
La velocidad de producción del potencial de acción en las células marcapasos se ve afectada, pero no controlada por el sistema nervioso autónomo .
El sistema nervioso simpático (nervios dominantes durante la respuesta de lucha o huida del cuerpo ) aumenta la frecuencia cardíaca ( cronotropía positiva ), al disminuir el tiempo para producir un potencial de acción en el SAN. Los nervios de la médula espinal liberan una molécula llamada noradrenalina , que se une a los receptores de la membrana de la célula marcapasos llamados adrenoceptores β1 y los activa . Esto activa una proteína, llamada proteína G s (s por estimuladora). La activación de esta proteína G conduce a mayores niveles de AMPc en la célula (a través de la vía del AMPc ). El AMPc se une a los canales HCN (ver arriba), aumentando la corriente divertida y, por lo tanto, aumentando la tasa de despolarización, durante el potencial de marcapasos. El aumento del AMPc también aumenta el tiempo de apertura de los canales de calcio de tipo L, aumentando la corriente de Ca 2+ a través del canal, acelerando la fase 0. [43]
El sistema nervioso parasimpático ( nervios dominantes mientras el cuerpo está en reposo y digiriendo) disminuye la frecuencia cardíaca ( cronotropía negativa ), al aumentar el tiempo necesario para producir un potencial de acción en el SAN. Un nervio llamado nervio vago , que comienza en el cerebro y viaja al nódulo sinoatrial, libera una molécula llamada acetilcolina (ACh) que se une a un receptor ubicado en el exterior de la célula marcapasos, llamado receptor muscarínico M2 . Esto activa una proteína G i (I por inhibidora), que se compone de 3 subunidades (α, β y γ) que, cuando se activan, se separan del receptor. Las subunidades β y γ activan un conjunto especial de canales de potasio, lo que aumenta el flujo de potasio fuera de la célula y disminuye el potencial de membrana, lo que significa que las células marcapasos tardan más en alcanzar su valor umbral. [44] La proteína G i también inhibe la vía del AMPc, reduciendo así los efectos simpáticos causados por los nervios espinales. [45]
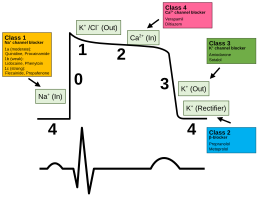
Los fármacos antiarrítmicos se utilizan para regular los ritmos cardíacos demasiado rápidos. Otros fármacos que se utilizan para influir en el potencial de acción cardíaco son los bloqueadores de los canales de sodio , los betabloqueantes , los bloqueadores de los canales de potasio y los bloqueadores de los canales de calcio .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )