La 3-dimetilaminoacroleína es un compuesto orgánico con la fórmula Me2NC ( H)=CHCHO. Es un líquido soluble en agua de color amarillo pálido. El compuesto tiene varias propiedades útiles e inusuales, por ejemplo, "provoca una inversión del efecto hipnótico de la morfina en ratones" y tiene un "efecto estimulante en humanos". [3]
Es un compuesto químico estable, a diferencia del compuesto original 3-aminoacroleína , [6] y se puede utilizar como un precursor comparativamente no tóxico para el malondialdehído genotóxico, mutagénico y potencialmente cancerígeno . [7] El compuesto puede considerarse como dimetilformamida viníloga (DMF) y combina las funcionalidades de un aldehído insaturado y una enamina. Por lo tanto, la 3-dimetilaminoacroleína y las vinamidinas derivadas de ella (compuestas de amidinas vinílogas) o las sales de vinamidinio (1,5-diazapentadienos sustituidos) [8] se pueden utilizar como bloques de construcción moleculares reactivos para la formación de heterociclos que contienen nitrógeno, como piridinas, pirimidinas, pirroles o pirazoles. [9]
La 3-dimetilaminoacroleína se obtiene mediante la adición de dimetilamina al triple enlace del propinal (propargilaldehído) a través de una vinilación de Reppe . [3]
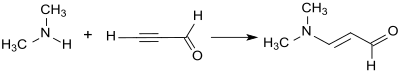
Sin embargo, el propinal es un material de partida inadecuado para la síntesis industrial debido a su tendencia a explotar. [10] Los éteres vinílicos (como el etil vinil éter) son más adecuados. [11] Reaccionan con fosgeno y dimetilformamida (que forma in situ el reactivo de Vilsmeier) con un rendimiento del 68 % para formar cloruro de 3-etoxipropeniliden dimetilamonio, una sal de iminio de éter enólico. En el medio débilmente alcalino, se forma a partir de él 3-dimetilaminoacroleína, que escinde la dimetilamina para formar propanedial tras la exposición a bases fuertes (como el hidróxido de sodio ).

En una ruta alternativa, el éter de vinilo isobutil reacciona con el cloruro de iminio derivado de DMF y fosgeno . La conversión se puede implementar en un proceso continuo. [4] La sal de iminio produce 3-dimetilaminoacroleína en solución de hidróxido de sodio diluido con un rendimiento del 86%. [12]

En lugar de fosgeno, la sal de iminio también se puede preparar mediante un cloruro de ácido inorgánico, como el tricloruro de fosforilo o un cloruro de ácido orgánico, como el cloruro de oxalilo .
La 3-dimetilaminoacroleína se puede utilizar para introducir grupos C3 insaturados y reactivos en compuestos CH-ácidos y nucleofílicos.
El grupo aldehído activado de la 3-dimetilaminoacroleína reacciona cuantitativamente con sulfatos de dialquilo, como el sulfato de dimetilo. Los productos son reactivos pero inestables [13] y se descomponen a 110 °C para volver a convertirse en los materiales de partida. Los productos se pueden transformar fácilmente con nucleófilos, como alcóxidos o aminas, en los correspondientes acetales de amida vinílicos o amidinas. [14]

El dimetilacetal de 3-dimetilaminoacroleína estable se obtiene por reacción con metóxido de sodio con un rendimiento del 62%. La 3-dimetilaminoacroleína se puede hacer reaccionar con compuestos ácidos CH (como malononitrilo) para formar derivados de 1,3-butadieno o con ciclopentadieno para formar un aminofulveno.
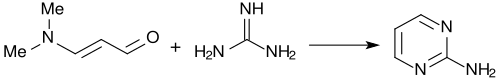
Con guanidina, la 3-dimetilaminoacroleína forma casi cuantitativamente 2-aminopirimidina. [4]
La amidina formada con 2-naftilamina y el aducto de sulfato de dimetilo se puede ciclar con metóxido de sodio para dar benzo[f]quinolina (1-azafenantreno). [15]
![Síntesis de benzo[f]quinolina con 3-dimetilaminoacroleína](http://upload.wikimedia.org/wikipedia/commons/thumb/6/68/Synthese_von_1-Azaphenanthren.svg/400px-Synthese_von_1-Azaphenanthren.svg.png)
El N -metilpirrol forma el 3-(2- N -metilpirrol)propenal con 3-dimetilaminoacroleína y POCl3 con un rendimiento del 49%. [16]

De manera similar, la preparación de un intermedio para el fármaco reductor del colesterol fluvastatina mediante la reacción de un N -isopropilindol sustituido con fluoroarilo con 3-dimetilaminoacroleína y POCl3 se realiza de manera similar. [17] [18]

Ocasionalmente, la sal de iminio de la reacción del reactivo de Vilsmeier y el éter vinílico (un precursor del 3-dimetilaminopropenal) se utiliza directamente para la síntesis, por ejemplo para pirazoles. [19]

Cuando se utiliza hidrato de hidrazina , se forma un cuerpo parental de pirazol con un rendimiento del 84%.
La reacción de la 3-dimetilaminoacroleína con tetrafluoroborato de dimetilamonio produce de forma prácticamente cuantitativa la sal de vinamidinio tetrafluoroborato de dimetiliminio de 3-dimetilaminoacroleína, que cristaliza mejor como sal de perclorato. La sal reacciona también con ciclopentadieno en presencia de amida sódica en amoníaco líquido para dar el derivado aminofulveno. [20]
El mismo cloruro de 1,1,5,5-tetrametil-1,5-diazapentadienio, sal de vinamidinio, también se forma en la reacción de 3-dimetilaminoacroleína con clorhidrato de dimetilamina con un rendimiento del 70%. [21] La reacción de dos pasos de dimetilamina y ácido perclórico al 70% con 3-dimetilaminoacroleína forma la misma sal de iminio (en adelante denominada perclorato de 1,3-bis(dimetilamino)trimetiniio). [22]

Las lactonas (por ejemplo, γ-butirolactona) o cetonas cíclicas (como ciclopentanona) forman con la sal de vinilamidinio de 3-dimetilaminoacroleína y el clorhidrato de dimetilamina las dienaminonas correspondientes con un rendimiento del 91% y 88%. [23]

El cloruro de 1,1,5,5-tetrametil-1,5-diazapentadienio, sal de vinamidinio, reacciona con heterociclos que portan grupos CH-ácidos para formar las dienaminas correspondientes que pueden ciclarse con bases para formar heteroaromáticos fusionados, como carbazoles, benzofuranos o benzotiofenos. [8]
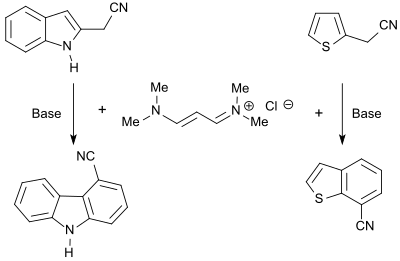
Los N -alquilpirroles se obtienen con buen rendimiento (86%) en la reacción de la sal de vinamidinio con ésteres de glicina, [24] tiofenos sustituidos (hasta 87%) en la reacción con ésteres de ácido mercaptoacético . [25]

El uso de 3-dimetilaminoacroleína para la síntesis de ácido 2-cloronicotínico (2-CNA) es de interés industrial como material de partida importante para productos agroquímicos y farmacéuticos. Para ello, la 3-dimetilaminoacroleína se hace reaccionar con éster etílico de ácido cianoacético [26] para formar éster etílico de ácido 2-cloronicotínico o con éster n-butílico de ácido cianoacético para formar éster n-butílico de ácido 2-cloronicotínico [27] en una reacción de Knoevenagel.
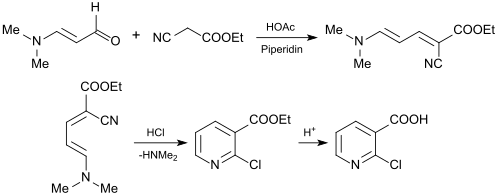
Los ésteres resultantes del ácido 2-cloropiridina carboxílico se pueden hidrolizar sin problemas a ácido 2-cloronicotínico.
Reacciona débilmente alcalino y da con el cloruro de hierro (III) un color rojo intenso.