La olefinación de Peterson (también llamada reacción de Peterson ) es la reacción química de los carbaniones α-sililo ( 1 en el diagrama a continuación) con cetonas (o aldehídos ) para formar un β-hidroxisilano ( 2 ) que se elimina para formar alquenos ( 3 ). [1]
Se han publicado varias revisiones. [2] [3] [4] [5] [6]
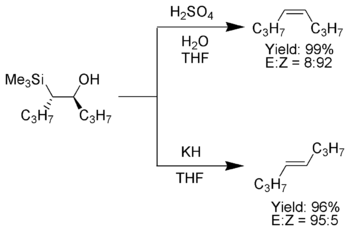
Una característica atractiva de la olefinación de Peterson es que se puede utilizar para preparar alquenos cis o trans a partir del mismo β-hidroxisilano. El tratamiento del β-hidroxisilano con ácido dará lugar a un alqueno, mientras que el tratamiento del mismo β-hidroxisilano con una base dará lugar a un alqueno de estereoquímica opuesta.
La acción de una base sobre un β-hidroxisilano ( 1 ) da como resultado una eliminación sinérgica concertada de ( 2 ) o ( 3 ) para formar el alqueno deseado. Se postula el intermedio de silicato penta-coordinado ( 3 ), pero hasta la fecha no existe ninguna prueba al respecto. [ ¿cuándo? ]
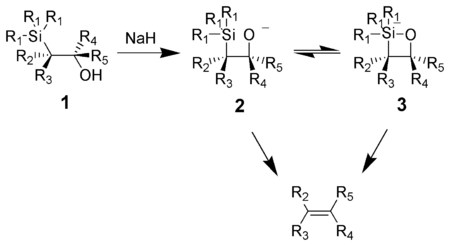
Los alcóxidos de potasio se eliminan rápidamente, mientras que los de sodio generalmente requieren calentamiento. Los de magnesio solo se eliminan en condiciones extremas. El orden de reactividad de los alcóxidos, K > Na >> Mg, es consistente con una mayor densidad electrónica en el oxígeno , lo que aumenta la nucleofilia del alcóxido.
El tratamiento del β-hidroxisilano ( 1 ) con ácido da como resultado la protonación y una antieliminación para formar el alqueno deseado.

Cuando el carbanión α-sililo contiene solo sustituyentes alquilo , hidrógeno o donadores de electrones , el resultado estereoquímico de la olefinación de Peterson se puede controlar, [7] porque a baja temperatura la eliminación es lenta y se puede aislar el intermedio β-hidroxisilano.
Una vez aislados, los β-hidroxisilanos diastereoméricos se separan. Un diastereómero se trata con ácido, mientras que el otro se trata con base, convirtiendo así el material en un alqueno con la estereoquímica requerida. [4]
Cuando el carbanión α-sililo contiene sustituyentes que atraen electrones, la olefinación de Peterson forma directamente el alqueno. El intermediario β-hidroxisilano no se puede aislar ya que se elimina in situ . En estos casos se ha postulado la vía de eliminación básica.
A diferencia de la reacción de Wittig , las olefinas de tipo Peterson toleran nitrilos . [8]
Las condiciones de eliminación ácidas a veces no son factibles ya que el ácido también promueve la isomerización del doble enlace . Además, la eliminación utilizando hidruro de sodio o potasio puede no ser factible debido a grupos funcionales incompatibles . Chan et al. han descubierto que la acilación del intermedio sililcarbinol con cloruro de acetilo o cloruro de tionilo da un éster β-silílico que se eliminará espontáneamente a 25 °C dando el alqueno deseado. [9] Corey y sus colaboradores desarrollaron un método (a veces denominado olefinación de Corey-Peterson [10] ) utilizando una imina sililada para producir un aldehído α,β-insaturado a partir de un compuesto carbonílico en un solo paso. [11] Para un ejemplo de su uso en síntesis total, consulte: Síntesis total de taxol de Kuwajima