
Los herbicidas fenoxi (o " fenoxis ") son dos familias de productos químicos que se han desarrollado como herbicidas de importancia comercial y que se utilizan ampliamente en la agricultura . Comparten la estructura parcial del ácido fenoxiacético .
El primer grupo que se descubrió actúa imitando la hormona de crecimiento auxina, el ácido indol acético (IAA). [1] Cuando se rocían sobre plantas de hoja ancha, inducen un crecimiento rápido y descontrolado ("crecimiento hasta la muerte"). Por lo tanto, cuando se aplican a cultivos monocotiledóneos como el trigo o el maíz , matan selectivamente las malezas de hoja ancha, dejando los cultivos relativamente intactos.
Introducidos en 1946, estos herbicidas se utilizaban ampliamente en la agricultura a mediados de la década de 1950. Los herbicidas fenoxi más conocidos son el ácido (4-cloro-2-metilfenoxi)acético ( MCPA ), el ácido 2,4-diclorofenoxiacético (2,4-D) y el ácido 2,4,5-triclorofenoxiacético (2,4,5-T). [2] Los análogos de cada uno de estos tres compuestos, con un grupo metilo adicional unido al lado del ácido carboxílico , se comercializaron posteriormente como mecoprop , diclorprop y fenoprop . La adición del grupo metilo crea un centro quiral en estas moléculas y la actividad biológica se encuentra solo en el isómero (2R) (ilustrado para el diclorprop). [3]
Otros miembros de este grupo incluyen el ácido 4-(2,4-diclorofenoxi)butírico ( 2,4-DB ) y el ácido 4-(4-cloro-2-metilfenoxi)butírico ( MCPB ), que actúan como propesticidas para 2,4-D y MCPA respectivamente: es decir, se convierten en plantas en estos ingredientes activos. [4] Todos los herbicidas auxínicos conservan la actividad cuando se aplican como sales y ésteres, ya que también son capaces de producir el ácido original in situ .

El uso de herbicidas en la agricultura estadounidense está mapeado por el Servicio Geológico de Estados Unidos. En 2019 [actualizar], el 2,4-D fue la auxina más utilizada. Ese año se rociaron 45 000 000 libras (20 000 000 kg), [5] en comparación con 2 000 000 libras (910 000 kg) del siguiente más aplicado, el MCPA. [6] La otra auxina que ahora se usa en cantidades comparables al 2,4-D es el dicamba , donde la cifra de 2019 fue de 30 000 000 libras (14 000 000 kg). [7] Es un ácido benzoico en lugar de un ácido fenoxiacético cuyo uso ha crecido rápidamente desde 2016 a medida que se han cultivado cultivos modificados genéticamente para ser resistentes a él. [8]
En la década de 1970, las empresas agroquímicas trabajaban para desarrollar nuevos herbicidas que complementaran a las auxinas. El objetivo era encontrar materiales que permitieran controlar selectivamente las malezas gramíneas en cultivos de hoja ancha como el algodón y la soja .

En 1973, Hoechst AG presentó patentes sobre una nueva clase de compuestos, los ariloxifenoxipropionatos, que mostraron tal selectividad y condujeron a la comercialización del diclofop. Luego, la empresa japonesa Ishihara Sangyo Kaisha (ISK) encontró una actividad biológica mejorada en un análogo, el clorazifop, que reemplazó la porción ariloxi del diclofop con un anillo de piridina que contenía los mismos dos sustituyentes de cloro. Esta área de investigación se volvió muy competitiva y, en un lapso de tres semanas entre sí, en 1977, ISK, Dow Chemicals e Imperial Chemical Industries (ICI) presentaron patentes que cubrían otro grupo de análogos, con un grupo trifluorometilo (CF3 ) en lugar de uno de los átomos de cloro en la piridina. Posteriormente, ISK e ICI licenciaron de forma cruzada su propiedad intelectual y comercializaron por primera vez el fluazifop como su éster butílico en 1981 bajo la marca Fusilade, mientras que Dow comercializó el haloxifop como su éster metílico. [9] Todos estos compuestos tienen un grupo aromático adicional unido al oxígeno en la posición para del anillo de fenilo con su grupo OCH(CH 3 )COOH y como clase se denominan "fops", en referencia a su característica común fenoxi-fenoxi [sic]. [10]
Este grupo de herbicidas actúa inhibiendo la acetil-CoA carboxilasa de las plantas (ACCase), un mecanismo de acción completamente diferente al de las auxinas. [11] [12] Su selectividad para las gramíneas surge porque se dirigen a la isoforma de la enzima presente solo en los plástidos de estas especies, lo que los hace ineficaces en malezas de hoja ancha y otros organismos, incluidos los mamíferos. [13] Cuando se aplica como un éster, el metabolismo en la planta objetivo conduce al ácido parental que es responsable de la acción herbicida. [9] [14] Es una coincidencia que sea el estereoisómero (2R) el que se une a la ACCasa de la planta, así como ese isómero es responsable de la actividad del diclorprop como auxina.
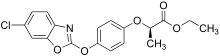

Las sales y ésteres de esta clase de herbicidas son activos debido a su capacidad de metabolizarse al ácido parental correspondiente. Por ejemplo, el fenoxaprop-P etil [15] fue introducido por Bayer Crop Science y el quizalofop-P etil por Nissan Chemical Corporation , ambos en 1989. [16] En 1990, Dow introdujo el cihalofop-P butil para el control de malezas en el arroz. [17] El fluazifop-P butil [18] todavía tiene un uso significativo en los EE. UU. Se aplicaron 200 000 libras (91 000 kg) en 2018, casi exclusivamente en soja. [19] La "P" en el nombre de estos materiales se refiere a su uso ahora como enantiómeros individuales .
Cummins et al. , 1999, 2009 y 2013 encuentran que el mecanismo de resistencia al fenoxaprop-P-etilo de Alopecurus myocuroides reduce las concentraciones de peróxido de hidrógeno en el sitio de aplicación, mientras que el tipo silvestre responde con un aumento. [20]