La guanidina es un compuesto con la fórmula HNC(NH2 ) 2 . Es un sólido incoloro que se disuelve en disolventes polares . Es una base fuerte que se utiliza en la producción de plásticos y explosivos . Se encuentra en la orina predominantemente en pacientes con insuficiencia renal. [4] Una fracción de guanidina también aparece en moléculas orgánicas más grandes, incluida la cadena lateral de la arginina .
La guanidina puede considerarse un análogo nitrogenado del ácido carbónico . Es decir, el grupo C=O en el ácido carbónico se reemplaza por un grupo C=NH y cada OH se reemplaza por un NH
2[5] El isobuteno puede considerarse un análogo del carbono de la misma manera. Se dilucidó un análisis cristalográfico detallado de la guanidina 148 años después de su primera síntesis, a pesar de la simplicidad de la molécula. [ 6] En 2013, se determinaron con precisión las posiciones de los átomos de hidrógeno y sus parámetros de desplazamiento utilizando difracción de neutrones de cristal único. [7]
La guanidina se puede obtener de fuentes naturales, siendo aislada por primera vez en 1861 por Adolph Strecker a través de la degradación oxidativa de un producto natural aromático, la guanina , aislado del guano peruano . [8] [9]
Un método de laboratorio para producir guanidina es la descomposición térmica suave (180-190 °C) del tiocianato de amonio seco en condiciones anhidras:
La ruta comercial implica un proceso de dos pasos que comienza con la reacción de diciandiamida con sales de amonio . A través de la intermediación de biguanidina , este paso de amonolisis produce sales del catión guanidinio (ver más abajo). En el segundo paso, la sal se trata con una base, como el metóxido de sodio . [8]
Las sales de isotiouronio ( tioureas S-alquiladas ) reaccionan con aminas para dar sales de guanidinio : [10]
Los iones guanidinio resultantes pueden desprotonarse para dar guanidina. Este método se denomina a veces síntesis de Rathke, en honor a su descubridor. Bernhard Rathke [11] [12]
El ácido conjugado se llama catión guanidinio , ( C(NH
2)+
3). Este ion plano y simétrico consta de tres grupos amino , cada uno unido al átomo de carbono central con un enlace covalente de orden 4/3. Es un catión +1 altamente estable en solución acuosa debido a la eficiente estabilización por resonancia de la carga y la eficiente solvatación por moléculas de agua. Como resultado, su p K aH es 13,6 [2] (p K b de 0,4), lo que significa que la guanidina es una base muy fuerte en agua; en agua neutra, existe casi exclusivamente como guanidinio. Debido a esto, la mayoría de los derivados de guanidina son sales que contienen el ácido conjugado.
La guanidina se puede detectar selectivamente utilizando ácido 1,2-naftoquinona-4-sulfónico de sodio ( reactivo de Folin ) y urea acidificada. [13]
La principal sal de interés comercial es el nitrato [C( NH
2) 3 ] NO
3Se utiliza como propulsor, por ejemplo en bolsas de aire .
Desde la Edad Media en Europa, la guanidina se ha utilizado para tratar la diabetes como ingrediente antihiperglucémico activo en la lila francesa . Debido a su hepatotoxicidad a largo plazo , la investigación adicional para el control del azúcar en sangre se suspendió al principio después del descubrimiento de la insulina. El desarrollo posterior de biguanidas no tóxicas y seguras condujo al medicamento de primera línea para el control de la diabetes de uso prolongado, la metformina , que se introdujo en Europa en la década de 1950 y en los Estados Unidos en 1995 y ahora se prescribe a más de 17 millones de pacientes por año en los EE. UU. [14] [15]
El cloruro de guanidinio [14] es un coadyuvante que actualmente genera controversia en el tratamiento del botulismo . Estudios recientes han demostrado que algunos subgrupos significativos de pacientes no experimentan ninguna mejoría después de la administración de este fármaco. [16]
La guanidina existe protonada, como guanidinio, en solución a pH fisiológico.
El cloruro de guanidinio (también conocido como clorhidrato de guanidina) tiene propiedades caotrópicas y se utiliza para desnaturalizar proteínas. Se sabe que el cloruro de guanidinio desnaturaliza proteínas con una relación lineal entre la concentración y la energía libre de desdoblamiento. En soluciones acuosas que contienen 6 M de cloruro de guanidinio, casi todas las proteínas pierden toda su estructura secundaria y se convierten en cadenas peptídicas enrolladas al azar . El tiocianato de guanidinio también se utiliza por su efecto desnaturalizante en diversas muestras biológicas.
Estudios recientes sugieren que las bacterias producen guanidinio como un subproducto tóxico. Para aliviar la toxicidad del guanidinio, las bacterias han desarrollado una clase de transportadores conocidos como exportadores de guanidinio o proteínas Gdx para expulsar las cantidades adicionales de este ion al exterior de la célula. [17] Las proteínas Gdx son altamente selectivas para el guanidinio y los compuestos guanidinílicos monosustituidos y comparten un conjunto superpuesto de sustratos no canónicos con el exportador de fármacos EmrE. [18]
El hidróxido de guanidinio es el ingrediente activo de algunos relajantes capilares sin lejía .
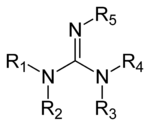
Las guanidinas son un grupo de compuestos orgánicos que comparten un grupo funcional común con la estructura general (R
1R
2N)(R
3R
4N)C=N−R
5El enlace central dentro de este grupo es el de una imina , y el grupo está relacionado estructuralmente con las amidinas y las ureas. Ejemplos de guanidinas son la arginina , el triazabiciclodeceno , la saxitoxina y la creatina .
La galegina es una guanidina isoamileno . [19]