Las monocapas autoensambladas ( SAM ) de moléculas orgánicas son ensamblajes moleculares formados espontáneamente en superficies por adsorción y están organizadas en dominios ordenados más o menos grandes. [1] [2] En algunos casos, las moléculas que forman la monocapa no interactúan fuertemente con el sustrato. Este es el caso, por ejemplo, de las redes supramoleculares bidimensionales [3] de, por ejemplo, el dianhídrido perilenotetracarboxílico (PTCDA) sobre oro [4] o de, por ejemplo, las porfirinas sobre grafito pirolítico altamente orientado (HOPG). [5] En otros casos, las moléculas poseen un grupo de cabeza que tiene una fuerte afinidad con el sustrato y ancla la molécula a él. [6] Una SAM de este tipo que consta de un grupo de cabeza, una cola y un grupo final funcional se representa en la Figura 1. Los grupos de cabeza comunes incluyen tioles , silanos , fosfonatos , etc.
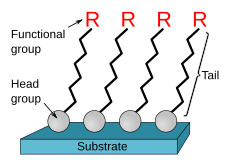
Los SAM se crean por la quimisorción de "grupos de cabeza" sobre un sustrato desde la fase de vapor o líquida [7] [8] seguida de una organización lenta de "grupos de cola". [9] Inicialmente, a baja densidad molecular en la superficie, las moléculas adsorbidas forman una masa desordenada de moléculas o forman una "fase acostada" bidimensional ordenada, [7] y a mayor cobertura molecular, durante un período de minutos a horas, comienzan a formar estructuras cristalinas o semicristalinas tridimensionales en la superficie del sustrato. [10] Los "grupos de cabeza" se reúnen en el sustrato, mientras que los grupos de cola se reúnen lejos del sustrato. Las áreas de moléculas compactas se nuclean y crecen hasta que la superficie del sustrato está cubierta por una sola monocapa.
Las moléculas adsorbidas se adsorben fácilmente porque reducen la energía libre superficial del sustrato [1] y son estables debido a la fuerte quimisorción de los "grupos de cabeza". Estos enlaces crean monocapas que son más estables que los enlaces fisisorbidos de las películas de Langmuir-Blodgett . [11] [12] Un "grupo de cabeza" basado en triclorosilano , por ejemplo en una molécula de FDTS , reacciona con un grupo hidroxilo en un sustrato y forma un enlace covalente muy estable [R-Si-O-sustrato] con una energía de 452 kJ/mol. Los enlaces tiol-metal son del orden de 100 kJ/mol, lo que los hace bastante estables en una variedad de temperaturas, solventes y potenciales. [10] La monocapa se empaqueta firmemente debido a las interacciones de van der Waals , [1] [12] reduciendo así su propia energía libre. [1] La adsorción se puede describir mediante la isoterma de adsorción de Langmuir si se descuidan las interacciones laterales. Si no se pueden descuidar, la adsorción se describe mejor mediante la isoterma de Frumkin . [10]
La selección del tipo de grupo de cabeza depende de la aplicación del SAM. [1] Normalmente, los grupos de cabeza están conectados a una cadena molecular en la que el extremo terminal se puede funcionalizar (es decir, añadiendo grupos –OH, –NH2, –COOH o –SH) para variar las propiedades humectantes e interfaciales. [11] [13] Se elige un sustrato apropiado para reaccionar con el grupo de cabeza. Los sustratos pueden ser superficies planas, como silicio y metales, o superficies curvas, como nanopartículas. Los alcanotioles son las moléculas más utilizadas para los SAM. Los alcanotioles son moléculas con una cadena alquílica, cadena (CC)ⁿ, como esqueleto, un grupo de cola y un grupo de cabeza SH. Otros tipos de moléculas interesantes incluyen tioles aromáticos, de interés en la electrónica molecular, en los que la cadena de alcanos se sustituye (parcialmente) por anillos aromáticos. Un ejemplo es el ditiol 1,4 - Bencenodimetanotiol ( SHCH2C6H4CH2SH ) ) . El interés en estos ditioles surge de la posibilidad de unir los dos extremos de azufre a contactos metálicos, lo que se utilizó por primera vez en mediciones de conducción molecular. [14] Los tioles se utilizan con frecuencia en sustratos de metales nobles debido a la fuerte afinidad del azufre por estos metales. La interacción azufre-oro es semicovalente y tiene una fuerza de aproximadamente 45 kcal/mol. Además, el oro es un material inerte y biocompatible que es fácil de adquirir. También es fácil de modelar mediante litografía, una característica útil para aplicaciones en sistemas nanoelectromecánicos (NEMS). [1] Además, puede soportar tratamientos de limpieza química agresivos. [10] Recientemente, otros SAM calcogenuros: seleniuros y telururos han atraído la atención [15] [16] en una búsqueda de diferentes características de enlace a sustratos que afecten a las características del SAM y que podrían ser de interés en algunas aplicaciones como la electrónica molecular. Los silanos se utilizan generalmente en superficies de óxido no metálico; [1] Sin embargo, las monocapas formadas a partir de enlaces covalentes entre silicio y carbono u oxígeno no pueden considerarse autoensambladas porque no se forman de manera reversible. Las monocapas autoensambladas de tiolatos sobre metales nobles son un caso especial porque los enlaces metal-metal se vuelven reversibles después de la formación del complejo tiolato-metal. [17] Esta reversibilidad es lo que da lugar a las islas de vacantes y es la razón por la que las SAM de los alcanotiolatos pueden desorberse térmicamente y sufrir intercambio con tioles libres. [18]
Los sustratos metálicos para su uso en SAM se pueden producir mediante técnicas de deposición física de vapor , electrodeposición o deposición electrolítica. [1] Los SAM de tiol o selenio producidos por adsorción a partir de una solución se fabrican típicamente sumergiendo un sustrato en una solución diluida de alcano tiol en etanol, aunque se pueden utilizar muchos disolventes diferentes [1] además del uso de líquidos puros. [16] Si bien a menudo se permite que los SAM se formen durante 12 a 72 horas a temperatura ambiente, [10] [19] los SAM de alcanotiolatos se forman en minutos. [20] [21] Es esencial prestar especial atención en algunos casos, como el de los SAM de ditiol para evitar problemas debido a la oxidación o procesos fotoinducidos, que pueden afectar a los grupos terminales y provocar desorden y formación de múltiples capas. [22] [23] En este caso, la elección apropiada de los disolventes, su desgasificación mediante gases inertes y la preparación en ausencia de luz son cruciales [22] [23] y permiten la formación de SAM "en pie" con grupos -SH libres. Las monocapas autoensambladas también pueden adsorberse desde la fase de vapor. [8] [24] En algunos casos, cuando la obtención de un ensamblaje ordenado es difícil o cuando se necesitan obtener fases de densidad diferentes, se utiliza el autoensamblaje sustitutivo. Aquí primero se forma el SAM de un tipo dado de moléculas, que dan lugar al ensamblaje ordenado y luego se realiza una segunda fase de ensamblaje (por ejemplo, por inmersión en una solución diferente). Este método también se ha utilizado para proporcionar información sobre las fuerzas de unión relativas de los SAM con diferentes grupos de cabeza y, de manera más general, sobre las características de autoensamblaje. [18] [25]
Los espesores de los SAM se pueden medir utilizando elipsometría y espectroscopia de fotoelectrones de rayos X (XPS) , que también brindan información sobre las propiedades interfaciales. [22] [26] El orden en el SAM y la orientación de las moléculas se pueden investigar mediante estudios de estructura fina de absorción de rayos X de borde cercano (NEXAFS) y espectroscopia infrarroja por transformada de Fourier en espectroscopia infrarroja de absorción por reflexión (RAIRS) [20] [23] . Se utilizan numerosas otras técnicas espectroscópicas [8] como generación de segundo armónico (SHG), generación de suma de frecuencias (SFG), dispersión Raman mejorada en la superficie (SERS), así como [27] espectroscopia de pérdida de energía de electrones de alta resolución (HREELS) . Las estructuras de los SAM se determinan comúnmente utilizando técnicas de microscopía de sonda de barrido como microscopía de fuerza atómica (AFM) y microscopía de efecto túnel de barrido (STM). La STM ha sido capaz de ayudar a entender los mecanismos de formación de SAM, así como determinar las características estructurales importantes que le otorgan a los SAM su integridad como entidades estables en la superficie. En particular, la STM puede obtener imágenes de la forma, la distribución espacial, los grupos terminales y su estructura de empaquetamiento. La AFM ofrece una herramienta igualmente poderosa sin el requisito de que el SAM sea conductor o semiconductor. La AFM se ha utilizado para determinar la funcionalidad química, la conductancia, las propiedades magnéticas, la carga superficial y las fuerzas de fricción de los SAM. [28] La técnica de electrodo vibratorio de barrido (SVET) es otra microscopía de sonda de barrido que se ha utilizado para caracterizar los SAM, con SAM libres de defectos que muestran una actividad homogénea en SVET. [29] Sin embargo, más recientemente, también se han utilizado métodos difractivos. [1] La estructura se puede utilizar para caracterizar la cinética y los defectos encontrados en la superficie de la monocapa. Estas técnicas también han mostrado diferencias físicas entre los SAM con sustratos planos y sustratos de nanopartículas. Un instrumento de caracterización alternativo para medir el autoensamblaje en tiempo real es la interferometría de polarización dual , donde se cuantifican a alta resolución el índice de refracción, el espesor, la masa y la birrefringencia de la capa autoensamblada. Otro método que se puede utilizar para medir el autoensamblaje en tiempo real es la microbalanza de cristal de cuarzo con tecnología de monitorización de disipación, donde se cuantifican la masa y las propiedades viscoelásticas de la capa. Ángulo de contactoLas mediciones se pueden utilizar para determinar la energía libre de la superficie que refleja la composición promedio de la superficie del SAM y se puede utilizar para investigar la cinética y la termodinámica de la formación de SAM. [20] [21] La cinética de adsorción y desorción inducida por temperatura, así como la información sobre la estructura, también se pueden obtener en tiempo real mediante técnicas de dispersión de iones, como la dispersión de iones de baja energía (LEIS) y la espectroscopia de retroceso directo de tiempo de vuelo (TOFDRS) . [24]
Pueden aparecer defectos debido a factores externos e intrínsecos. Los factores externos incluyen la limpieza del sustrato, el método de preparación y la pureza de los adsorbatos. [1] [10] Los SAM forman defectos intrínsecamente debido a la termodinámica de la formación, por ejemplo, los SAM de tiol en oro suelen presentar picaduras de grabado (islas de vacantes monoatómicas) probablemente debido a la extracción de adatomos del sustrato y la formación de fracciones adatomo-adsorbato. Recientemente, se ha descubierto un nuevo tipo de fluorosurfactantes que pueden formar una monocapa casi perfecta sobre el sustrato de oro debido al aumento de la movilidad de los átomos de la superficie del oro. [30] [31] [32]
La estructura de los SAM también depende de la curvatura del sustrato. Los SAM en nanopartículas, incluidos coloides y nanocristales, "estabilizan la superficie reactiva de la partícula y presentan grupos funcionales orgánicos en la interfaz partícula-disolvente". [1] Estos grupos funcionales orgánicos son útiles para aplicaciones, como inmunoensayos o sensores , que dependen de la composición química de la superficie. [1]
Hay evidencia de que la formación de SAM ocurre en dos pasos: un paso inicial rápido de adsorción y un segundo paso más lento de organización de la monocapa. La adsorción ocurre en las interfaces líquido-líquido, líquido-vapor y líquido-sólido. El transporte de moléculas a la superficie ocurre debido a una combinación de difusión y transporte convectivo. De acuerdo con el modelo cinético de Langmuir o Avrami, la tasa de deposición sobre la superficie es proporcional al espacio libre de la superficie. [7]
Donde θ es la cantidad proporcional de área depositada y k es la constante de velocidad. Aunque este modelo es robusto, solo se utiliza para aproximaciones porque no tiene en cuenta los procesos intermedios. [7] La interferometría de polarización dual, al ser una técnica en tiempo real con una resolución de ~10 Hz, puede medir la cinética del autoensamblaje de monocapas directamente.
Una vez que las moléculas están en la superficie, la autoorganización ocurre en tres fases: [7]
Las transiciones de fase en las que se forma un SAM dependen de la temperatura del entorno en relación con la temperatura del punto triple, la temperatura en la que la punta de la fase de baja densidad se cruza con la región de la fase intermedia. A temperaturas inferiores al punto triple, el crecimiento pasa de la fase 1 a la fase 2, donde se forman muchas islas con la estructura SAM final, pero están rodeadas de moléculas aleatorias. De manera similar a la nucleación en los metales, a medida que estas islas crecen, se cruzan formando límites hasta que terminan en la fase 3, como se ve a continuación. [7]
A temperaturas superiores al punto triple, el crecimiento es más complejo y puede tomar dos caminos. En el primer camino, las cabezas de las SAM se organizan hasta sus posiciones casi finales con los grupos de cola formados de forma suelta en la parte superior. Luego, a medida que pasan a la fase 3, los grupos de cola se ordenan y se enderezan. En el segundo camino, las moléculas comienzan en una posición acostada a lo largo de la superficie. Luego, se forman islas de SAM ordenadas, donde crecen hasta la fase 3, como se ve a continuación. [7]
La naturaleza en la que los grupos de cola se organizan en una monocapa ordenada recta depende de la atracción intermolecular, o fuerzas de van der Waals , entre los grupos de cola. Para minimizar la energía libre de la capa orgánica, las moléculas adoptan conformaciones que permiten un alto grado de fuerzas de Van der Waals con algún enlace de hidrógeno. El pequeño tamaño de las moléculas SAM es importante aquí porque las fuerzas de Van der Waals surgen de los dipolos de las moléculas y, por lo tanto, son mucho más débiles que las fuerzas de la superficie circundante a escalas mayores. El proceso de ensamblaje comienza con un pequeño grupo de moléculas, generalmente dos, acercándose lo suficiente como para que las fuerzas de Van der Waals superen la fuerza circundante. Las fuerzas entre las moléculas las orientan de modo que estén en su configuración recta y óptima. Luego, a medida que otras moléculas se acercan, interactúan con estas moléculas ya organizadas de la misma manera y se convierten en parte del grupo conformado. Cuando esto ocurre en un área grande, las moléculas se apoyan entre sí para formar su forma SAM que se ve en la Figura 1. La orientación de las moléculas se puede describir con dos parámetros: α y β. α es el ángulo de inclinación de la cadena principal con respecto a la normal de la superficie. En aplicaciones típicas, α varía de 0 a 60 grados dependiendo del sustrato y el tipo de molécula de SAM. β es el ángulo de rotación a lo largo del eje largo de la molécula de tee. β suele estar entre 30 y 40 grados. [1] En algunos casos se ha señalado la existencia de trampas cinéticas que dificultan la orientación ordenada final. [8] Así, en el caso de los ditioles, la formación de una fase "acostada" [8] se consideró un impedimento para la formación de la fase "erguida", sin embargo, varios estudios recientes indican que este no es el caso. [22] [23]
Muchas de las propiedades de SAM, como el espesor, se determinan en los primeros minutos. Sin embargo, pueden pasar horas hasta que se eliminen los defectos mediante el recocido y se determinen las propiedades finales de SAM. [7] [10] La cinética exacta de la formación de SAM depende de las propiedades del adsorbato, el solvente y el sustrato. Sin embargo, en general, la cinética depende tanto de las condiciones de preparación como de las propiedades del material del solvente, el adsorbato y el sustrato. [7] Específicamente, la cinética de la adsorción a partir de una solución líquida depende de: [1]
La estructura final del SAM también depende de la longitud de la cadena y de la estructura tanto del adsorbato como del sustrato. El impedimento estérico y las propiedades del sustrato metálico, por ejemplo, pueden afectar la densidad de empaquetamiento de la película, [1] [10] mientras que la longitud de la cadena afecta el espesor del SAM. [12] Una mayor longitud de la cadena también aumenta la estabilidad termodinámica. [1]
Esta primera estrategia implica depositar localmente monocapas autoensambladas sobre la superficie únicamente donde posteriormente se ubicará la nanoestructura . Esta estrategia es ventajosa porque implica métodos de alto rendimiento que generalmente implican menos pasos que las otras dos estrategias. Las principales técnicas que utilizan esta estrategia son: [33]
La estrategia de eliminación local comienza cubriendo toda la superficie con un SAM. Luego, se eliminan moléculas individuales de SAM de los lugares donde no se desea la deposición de nanoestructuras . El resultado es el mismo que en la estrategia de atracción local, la diferencia está en la forma en que se logra. Las principales técnicas que utilizan esta estrategia son: [33]
La estrategia final no se centra en la deposición o eliminación de SAMS, sino en la modificación de los grupos terminales. En el primer caso, el grupo terminal se puede modificar para eliminar funcionalidad de modo que la molécula de SAM sea inerte. En el mismo sentido, el grupo terminal se puede modificar para añadir funcionalidad [35] de modo que pueda aceptar materiales diferentes o tener propiedades diferentes a las del grupo terminal SAM original. Las principales técnicas que utilizan esta estrategia son: [33]
Los SAM son un recubrimiento de superficie económico y versátil para aplicaciones que incluyen control de humectación y adhesión, [36] resistencia química, biocompatibilidad, sensibilización y reconocimiento molecular para sensores [37] y nanofabricación. [7] Las áreas de aplicación de los SAM incluyen biología, electroquímica y electrónica, sistemas nanoelectromecánicos (NEMS) y sistemas microelectromecánicos (MEMS), y artículos domésticos de uso diario. Los SAM pueden servir como modelos para estudiar las propiedades de la membrana de células y orgánulos y la adhesión celular a superficies. [1] Los SAM también se pueden utilizar para modificar las propiedades de la superficie de los electrodos para electroquímica, electrónica general y varios NEMS y MEMS. [1] Por ejemplo, las propiedades de los SAM se pueden utilizar para controlar la transferencia de electrones en electroquímica. [38] Pueden servir para proteger metales de productos químicos agresivos y reactivos de ataque. Los SAM también pueden reducir la adherencia de componentes NEMS y MEMS en entornos húmedos. De la misma manera, los SAM pueden alterar las propiedades del vidrio. Un producto doméstico común, Rain-X , utiliza SAM para crear una monocapa hidrófoba en los parabrisas de los automóviles para protegerlos de la lluvia. Otra aplicación es un revestimiento antiadherente en herramientas y sellos de litografía de nanoimpresión (NIL). También se pueden recubrir herramientas de moldeo por inyección para la replicación de polímeros con un SAM de perfluorodeciltriclorosilano . [39]
Los SAM de película delgada también se pueden colocar en nanoestructuras . De esta manera, funcionalizan la nanoestructura . Esto es ventajoso porque la nanoestructura ahora puede unirse selectivamente a otras moléculas o SAM. Esta técnica es útil en biosensores u otros dispositivos MEMS que necesitan separar un tipo de molécula de su entorno. Un ejemplo es el uso de nanopartículas magnéticas para eliminar un hongo de un torrente sanguíneo. La nanopartícula se recubre con un SAM que se une al hongo. A medida que la sangre contaminada se filtra a través de un dispositivo MEMS, las nanopartículas magnéticas se insertan en la sangre donde se unen al hongo y luego son expulsadas magnéticamente del torrente sanguíneo hacia una corriente de desechos laminar cercana . [40]
Los métodos fotolitográficos son útiles para modelar SAM. [41] Los SAM también son útiles para depositar nanoestructuras , porque cada molécula de adsorbato se puede adaptar para atraer dos materiales diferentes. Las técnicas actuales utilizan la cabeza para atraer a una superficie, como una placa de oro. Luego, el grupo terminal se modifica para atraer un material específico como una nanopartícula particular , un cable, una cinta u otra nanoestructura . De esta manera, donde sea que el SAM se modele en una superficie, habrá nanoestructuras unidas a los grupos de cola. Un ejemplo es el uso de dos tipos de SAM para alinear nanotubos de carbono de pared simple , SWNT. Se utilizó nanolitografía con pluma de inmersión para modelar un SAM de ácido 16-mercaptohexadecanoico (MHA) y el resto de la superficie se pasiva con SAM de 1-octadecanotiol (ODT). El solvente polar que transporta los SWNT es atraído por el MHA hidrófilo ; a medida que el disolvente se evapora, los SWNT están lo suficientemente cerca del SAM del MHA para unirse a él debido a las fuerzas de Van der Waals . De este modo, los nanotubos se alinean con el límite MHA-ODT. Utilizando esta técnica, Chad Mirkin , Schatz y sus colaboradores pudieron crear formas bidimensionales complejas; a la derecha se muestra una representación de una forma creada. [33] [42] Otra aplicación de los SAM estampados es la funcionalización de biosensores . Los grupos de cola se pueden modificar para que tengan afinidad por células , proteínas o moléculas . A continuación, el SAM se puede colocar en un biosensor para que se pueda detectar la unión de estas moléculas. La capacidad de crear patrones de estos SAM permite colocarlos en configuraciones que aumentan la sensibilidad y no dañan ni interfieren con otros componentes del biosensor . [28]
Ha habido un interés considerable en el uso de SAM para nuevos materiales, por ejemplo, a través de la formación de superredes orgánicas metálicas bidimensionales o tridimensionales mediante el ensamblaje de nanopartículas cubiertas con SAM [43] o matrices de nanopartículas SAM capa por capa utilizando ditioles. [44] Hamoudi y Esaulov [45] ofrecen una revisión detallada sobre este tema utilizando ditioles .
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: CS1 maint: multiple names: authors list (link){{cite book}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link)