


En cristalografía , el sistema cristalino cúbico (o isométrico ) es un sistema cristalino en el que la celda unitaria tiene forma de cubo . Esta es una de las formas más comunes y simples que se encuentran en los cristales y minerales .
Hay tres variedades principales de estos cristales:
Nota: el término fcc se utiliza a menudo como sinónimo de la estructura cúbica compacta o ccp que se da en los metales. Sin embargo, fcc representa una red Bravais cúbica centrada en las caras, que no está necesariamente compacta cuando se coloca un motivo sobre las puntas de la red. Por ejemplo, las redes de diamante y de blenda de cinc son fcc pero no compactas. Cada una se subdivide en otras variantes que se enumeran a continuación. Aunque las celdas unitarias de estos cristales se consideran convencionalmente cubos, las celdas unitarias primitivas a menudo no lo son.
Los tres reticulados de Bravais en el sistema cristalino cúbico son:
La red cúbica primitiva (cP) consta de un punto de red en cada esquina del cubo; esto significa que cada celda unitaria cúbica simple tiene en total un punto de red. Cada átomo en un punto de red se comparte de manera igualitaria entre ocho cubos adyacentes y, por lo tanto, la celda unitaria contiene en total un átomo ( 1 ⁄ 8 × 8). [1]
La red cúbica centrada en el cuerpo (cI) tiene un punto de red en el centro de la celda unitaria además de los ocho puntos de esquina. Tiene un total neto de dos puntos de red por celda unitaria ( 1 ⁄ 8 × 8 + 1). [1]
La red cúbica centrada en las caras (cF) tiene puntos de red en las caras del cubo, cada uno de los cuales da exactamente la mitad de la contribución, además de los puntos de red de las esquinas, lo que da un total de cuatro puntos de red por celda unitaria ( 1 ⁄ 8 × 8 de las esquinas más 1 ⁄ 2 × 6 de las caras).
La red cúbica centrada en las caras está estrechamente relacionada con el sistema hexagonal compacto (hcp), en el que dos sistemas difieren únicamente en la ubicación relativa de sus capas hexagonales. El plano [111] de una red cúbica centrada en las caras es una cuadrícula hexagonal.
Al intentar crear una red cúbica centrada en la base (es decir, colocar un punto de red adicional en el centro de cada cara horizontal), se obtiene una red de Bravais tetragonal simple .
El número de coordinación (CN) es el número de vecinos más cercanos de un átomo central en la estructura. [1] Cada esfera en una red cP tiene un número de coordinación 6, en una red cI 8 y en una red cF 12.
El factor de empaquetamiento atómico (FPA) es la fracción de volumen que ocupan los átomos. La red cP tiene un FPA de aproximadamente 0,524, la red cI un FPA de aproximadamente 0,680 y la red cF un FPA de aproximadamente 0,740.
En la siguiente tabla se enumeran los nombres de las clases de sistemas cristalinos isométricos , los grupos puntuales (en notación de Schönflies , notación de Hermann–Mauguin , orbifold y notación de Coxeter ), el tipo, los ejemplos, las tablas internacionales para el número de grupo espacial de cristalografía [2] y los grupos espaciales . Hay un total de 36 grupos espaciales cúbicos.
Otros términos para hexoctaédrico son: clase normal, holoédrico, clase central ditesseral, tipo galena .

Como regla general, dado que los átomos en un sólido se atraen entre sí, las disposiciones de átomos más estrechamente empaquetados tienden a ser más comunes. (Sin embargo, se producen disposiciones de empaquetamiento débil, por ejemplo, si la hibridación orbital exige ciertos ángulos de enlace ). En consecuencia, la estructura cúbica primitiva, con un factor de empaquetamiento atómico especialmente bajo, es rara en la naturaleza, pero se encuentra en el polonio . [4] [5] El bcc y el fcc , con sus densidades más altas, son bastante comunes en la naturaleza. Los ejemplos de bcc incluyen hierro , cromo , tungsteno y niobio . Los ejemplos de fcc incluyen aluminio , cobre , oro y plata .
Otra estructura cristalina cúbica importante es la estructura cúbica del diamante , que puede aparecer en el carbono , el silicio , el germanio y el estaño . A diferencia de fcc y bcc, esta estructura no es una red, ya que contiene múltiples átomos en su celda primitiva . Otras estructuras elementales cúbicas incluyen la estructura A15 que se encuentra en el tungsteno y la estructura extremadamente complicada del manganeso .
Los compuestos que constan de más de un elemento (por ejemplo, compuestos binarios ) suelen tener estructuras cristalinas basadas en el sistema cristalino cúbico. Aquí se enumeran algunos de los más comunes. Estas estructuras pueden considerarse como dos o más subredes interpenetrantes, donde cada subred ocupa los sitios intersticiales de las otras.

Una de estas estructuras es la "estructura cúbica primitiva interpenetrante", también llamada "cloruro de cesio" o estructura B2. Esta estructura suele confundirse con una estructura cúbica centrada en el cuerpo porque la disposición de los átomos es la misma. Sin embargo, la estructura del cloruro de cesio tiene una base compuesta por dos especies atómicas diferentes. En una estructura cúbica centrada en el cuerpo, habría simetría traslacional a lo largo de la dirección [111]. En la estructura del cloruro de cesio, la traslación a lo largo de la dirección [111] da como resultado un cambio de especie. La estructura también puede considerarse como dos estructuras cúbicas simples separadas, una de cada especie, que se superponen una dentro de la otra. La esquina del cubo de cloruro es el centro del cubo de cesio y viceversa. [6]

Funciona de la misma manera para la estructura de NaCl que se describe en la siguiente sección. Si se eliminan los átomos de Cl, los átomos de Na restantes aún forman una estructura FCC, no una estructura cúbica simple.
En la celda unitaria del CsCl, cada ion está en el centro de un cubo de iones de tipo opuesto, por lo que el número de coordinación es ocho. El catión central está coordinado con 8 aniones en las esquinas de un cubo como se muestra y, de manera similar, el anión central está coordinado con 8 cationes en las esquinas de un cubo. Alternativamente, se podría ver esta red como una estructura cúbica simple con un átomo secundario en su vacío cúbico .
Además del cloruro de cesio en sí, la estructura también aparece en ciertos otros haluros alcalinos cuando se preparan a bajas temperaturas o altas presiones. [7] Generalmente, es más probable que esta estructura se forme a partir de dos elementos cuyos iones son aproximadamente del mismo tamaño (por ejemplo, radio iónico de Cs + = 167 pm y Cl − = 181 pm).
El grupo espacial de la estructura del cloruro de cesio (CsCl) se denomina Pm 3 m (en la notación de Hermann-Mauguin ) o "221" (en las Tablas Internacionales de Cristalografía). La designación Strukturbericht es "B2". [8]
Existen casi cien compuestos intermetálicos de tierras raras que cristalizan en la estructura CsCl, incluidos muchos compuestos binarios de tierras raras con magnesio , [9] y con elementos de los grupos 11 , 12 , [10] [11] y 13. Otros compuestos que muestran una estructura similar al cloruro de cesio son CsBr , CsI , RbCl de alta temperatura , AlCo, AgZn, BeCu, MgCe, RuAl y SrTl. [ cita requerida ]
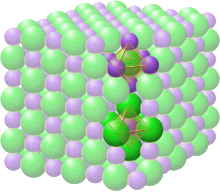
El grupo espacial de la estructura de la sal de roca o de la halita (cloruro de sodio) se denota como Fm 3 m (en la notación de Hermann-Mauguin ), o "225" (en las Tablas Internacionales de Cristalografía). La designación Strukturbericht es "B1". [12]
En la estructura de la sal de roca, cada uno de los dos tipos de átomos forma una red cúbica centrada en las caras separada, con las dos redes interpenetrándose de manera que forman un patrón de tablero de ajedrez en 3D. La estructura de la sal de roca tiene coordinación octaédrica : los vecinos más cercanos de cada átomo consisten en seis átomos del tipo opuesto, ubicados como los seis vértices de un octaedro regular . En el cloruro de sodio hay una proporción de 1:1 de átomos de sodio a cloro. La estructura también se puede describir como una red FCC de sodio con cloro ocupando cada vacío octaédrico o viceversa. [6]
Entre los ejemplos de compuestos con esta estructura se incluyen el propio cloruro de sodio, junto con casi todos los demás haluros alcalinos y "muchos óxidos de metales divalentes, sulfuros, seleniuros y telururos". [7] Según la regla de la relación de radios , es más probable que se forme esta estructura si el catión es algo más pequeño que el anión (una relación de radio catión/anión de 0,414 a 0,732).
La distancia interatómica (distancia entre catión y anión, o la mitad de la longitud de la celda unitaria a ) en algunos cristales con estructura de sal de roca son: 2,3 Å (2,3 × 10 −10 m) para NaF, [13] 2,8 Å para NaCl, [14] y 3,2 Å para SnTe. [15] La mayoría de los hidruros y haluros de metales alcalinos tienen la estructura de sal de roca, aunque algunos tienen la estructura de cloruro de cesio .
Muchos monóxidos de metales de transición también tienen la estructura de sal de roca ( TiO , VO , CrO , MnO , FeO , CoO , NiO , CdO ). Los primeros monocarburos actinoides también tienen esta estructura ( ThC , PaC, UC , NpC, PuC ). [37]
Al igual que la estructura de la sal de roca, la estructura de fluorita (AB 2 ) también es una estructura Fm 3 m pero tiene una proporción de iones de 1:2. La estructura de antifluorita es casi idéntica, excepto que las posiciones de los aniones y cationes están intercambiadas en la estructura. Se designan como posiciones de Wyckoff 4a y 8c, mientras que las posiciones de la estructura de sal de roca son 4a y 4b. [48] [49]

El grupo espacial de la estructura de Zincblenda se llama F 4 3m (en notación Hermann–Mauguin ), o 216. [50] [51] La designación Strukturbericht es "B3". [52]
La estructura de la blenda de cinc (también escrita "blenda de cinc") recibe su nombre del mineral blenda de cinc ( esfalrita ), una forma de sulfuro de cinc (β-ZnS). Al igual que en la estructura de sal de roca, los dos tipos de átomos forman dos redes cúbicas interpenetrantes centradas en las caras. Sin embargo, difiere de la estructura de sal de roca en cómo se posicionan las dos redes una con respecto a la otra. La estructura de la blenda de cinc tiene coordinación tetraédrica : los vecinos más cercanos de cada átomo consisten en cuatro átomos del tipo opuesto, posicionados como los cuatro vértices de un tetraedro regular . En el sulfuro de cinc, la relación de cinc a azufre es 1:1. [6] En conjunto, la disposición de los átomos en la estructura de la blenda de cinc es la misma que la estructura cúbica del diamante , pero con tipos de átomos alternados en los diferentes sitios de la red. La estructura también se puede describir como una red FCC de cinc con átomos de azufre que ocupan la mitad de los huecos tetraédricos o viceversa. [6]
Los ejemplos de compuestos con esta estructura incluyen la propia blenda de zinc, el nitrato de plomo (II) , muchos semiconductores compuestos (como el arseniuro de galio y el telururo de cadmio ) y una amplia gama de otros compuestos binarios. [ cita requerida ] Los pnictogenuros del grupo del boro suelen tener una estructura de blenda de zinc, aunque los nitruros son más comunes en la estructura de wurtzita , y sus formas de blenda de zinc son polimorfos menos conocidos . [ 53 ] [ 54 ]
Este grupo también se conoce como la familia de compuestos II-VI , la mayoría de los cuales pueden prepararse tanto en forma de blenda de zinc (cúbica) como de wurtzita (hexagonal).
Este grupo también se conoce como la familia de compuestos III-V .

La estructura de Heusler, basada en la estructura de Cu2MnAl , es una estructura común para los compuestos ternarios que involucran metales de transición . Tiene el grupo espacial Fm3m ( No. 225), y la designación Strukturbericht es L21 . Junto con los compuestos de semi-Heusler y de Huesler inverso estrechamente relacionados, hay cientos de ejemplos.

El grupo espacial de la estructura del monosiliciuro de hierro es P2 1 3 (n.º 198) y la designación Strukturbericht es B20. Se trata de una estructura quiral y, a veces, se asocia con propiedades helimagnéticas . Hay cuatro átomos de cada elemento, lo que hace un total de ocho átomos en la celda unitaria.
Se encuentran ejemplos de ellos entre los siliciuros y germanuros de metales de transición, así como algunos otros compuestos como el paladuro de galio .

Una estructura de Weaire-Phelan tiene simetría Pm 3 n (223).
Tiene tres orientaciones de tetradecaedros apilados con celdas piritoédricas en los huecos. Se encuentra como una estructura cristalina en química, donde generalmente se la conoce como " estructura de clatrato de tipo I ". Los hidratos de gas formados por metano, propano y dióxido de carbono a bajas temperaturas tienen una estructura en la que las moléculas de agua se encuentran en los nodos de la estructura de Weaire-Phelan y están unidas por enlaces de hidrógeno , y las moléculas de gas más grandes quedan atrapadas en las jaulas poliédricas.