

La isomería cis - trans , también conocida como isomería geométrica , describe ciertas disposiciones de los átomos dentro de las moléculas. Los prefijos " cis " y " trans " son del latín: "de este lado de" y "del otro lado de", respectivamente. [1] En el contexto de la química, cis indica que los grupos funcionales (sustituyentes) están en el mismo lado de algún plano, mientras que trans indica que están en lados opuestos (transversales). Los isómeros cis - trans son estereoisómeros , es decir, pares de moléculas que tienen la misma fórmula pero cuyos grupos funcionales se encuentran en diferentes orientaciones en el espacio tridimensional. Los isómeros cis y trans se encuentran tanto en moléculas orgánicas como en complejos de coordinación inorgánicos. Los descriptores cis y trans no se utilizan para casos de isomería conformacional donde las dos formas geométricas se interconvierten fácilmente, como la mayoría de las estructuras de enlace simple de cadena abierta; en cambio, se utilizan los términos " syn " y " anti ".
Según la IUPAC , "isomerismo geométrico" es un sinónimo obsoleto de " isomerismo cis - trans ". [2]
La isomería cis-trans o geométrica se clasifica como un tipo de isomería configuracional . [3]
En general, los estereoisómeros cis - trans contienen dobles enlaces o estructuras de anillos. En ambos casos se restringe o se impide la rotación de los bonos. [4] Cuando los grupos sustituyentes están orientados en la misma dirección, el diastereómero se denomina cis , mientras que cuando los sustituyentes están orientados en direcciones opuestas, el diastereómero se denomina trans . Un ejemplo de un pequeño hidrocarburo que muestra isomería cis - trans es el but-2-eno . El 1,2-diclorociclohexano es otro ejemplo.
Los isómeros cis y trans tienen propiedades físicas distintas. Sus diferentes formas influyen en los momentos dipolares , los puntos de ebullición y, especialmente, de fusión.
Estas diferencias pueden ser muy pequeñas, como en el caso del punto de ebullición de los alquenos de cadena lineal, como el pent-2-eno , que es de 37 °C en el isómero cis y de 36 °C en el isómero trans . [5] Las diferencias entre los isómeros cis y trans pueden ser mayores si hay enlaces polares presentes, como en los 1,2-dicloroetenos . El isómero cis en este caso tiene un punto de ebullición de 60,3 °C, mientras que el isómero trans tiene un punto de ebullición de 47,5 °C. [6] En el isómero cis , los dos momentos dipolares del enlace C-Cl polar se combinan para dar un dipolo molecular general, de modo que existen fuerzas intermoleculares dipolo-dipolo (o fuerzas de Keesom), que se suman a las fuerzas de dispersión de London y elevan el punto de ebullición. punto. En el isómero trans , por otro lado, esto no ocurre porque los dos momentos de enlace C-Cl se cancelan y la molécula tiene un momento dipolar neto cero (sin embargo, tiene un momento cuadrupolar distinto de cero ).
Las diferentes propiedades de los dos isómeros del ácido butenodioico suelen ser muy diferentes.
La polaridad es clave para determinar el punto de ebullición relativo, ya que fuertes fuerzas intermoleculares elevan el punto de ebullición. De la misma manera, la simetría es clave para determinar el punto de fusión relativo, ya que permite un mejor empaquetamiento en estado sólido, incluso si no altera la polaridad de la molécula. Otro ejemplo de esto es la relación entre el ácido oleico y el ácido elaídico ; El ácido oleico, el isómero cis , tiene un punto de fusión de 13,4 °C, lo que lo convierte en líquido a temperatura ambiente, mientras que el isómero trans , el ácido elaídico, tiene un punto de fusión mucho más alto de 43 °C, debido a que el isómero trans más recto es capaz de empaquetarse más firmemente y es sólido a temperatura ambiente.
Así, los alquenos trans , que son menos polares y más simétricos, tienen puntos de ebullición más bajos y puntos de fusión más altos, y los alquenos cis , que generalmente son más polares y menos simétricos, tienen puntos de ebullición más altos y puntos de fusión más bajos.
En el caso de isómeros geométricos que son consecuencia de dobles enlaces y, en particular, cuando ambos sustituyentes son iguales, suelen observarse algunas tendencias generales. Estas tendencias pueden atribuirse al hecho de que los dipolos de los sustituyentes en un isómero cis se sumarán para dar un dipolo molecular general. En un isómero trans , los dipolos de los sustituyentes se cancelarán [7] debido a que están en lados opuestos de la molécula. Los isómeros trans también tienden a tener densidades más bajas que sus homólogos cis . [ cita necesaria ]
Como tendencia general, los alquenos trans tienden a tener puntos de fusión más altos y una menor solubilidad en disolventes inertes, ya que los alquenos trans , en general, son más simétricos que los alquenos cis . [8]
Las constantes de acoplamiento vecinales ( 3 J HH ), medidas por espectroscopia de RMN , son mayores para los isómeros trans (rango: 12–18 Hz; típico: 15 Hz) que para cis (rango: 0–12 Hz; típico: 8 Hz). [9]
Por lo general, en los sistemas acíclicos los isómeros trans son más estables que los isómeros cis . Esta diferencia se atribuye a la interacción estérica desfavorable de los sustituyentes en el isómero cis . Por lo tanto, los isómeros trans tienen un calor de combustión menos exotérmico , lo que indica una mayor estabilidad termoquímica . [8] En el conjunto de datos de aditividad del grupo de calor de formación de Benson , los isómeros cis sufren una penalización de estabilidad de 1,10 kcal/mol. Existen excepciones a esta regla, como el 1,2-difluoroetileno , el 1,2-difluorodiazeno (FN=NF) y varios otros etilenos sustituidos con halógeno y oxígeno. En estos casos, el isómero cis es más estable que el isómero trans . [10] Este fenómeno se llama efecto cis . [11]

En principio, la notación cis - trans no debe usarse para alquenos con dos o más sustituyentes diferentes. En cambio , se utiliza la notación E – Z en función de la prioridad de los sustituyentes utilizando las reglas de prioridad de Cahn-Ingold-Prelog (CIP) para la configuración absoluta. Las designaciones estándar de la IUPAC E y Z son inequívocas en todos los casos y, por lo tanto, son especialmente útiles para alquenos tri y tetrasustituidos para evitar cualquier confusión sobre qué grupos se identifican como cis o trans entre sí.
Z (del alemán zusammen ) significa "juntos". E (del alemán entgegen ) significa "opuesto" en el sentido de "opuesto". Es decir, Z tiene los grupos de mayor prioridad cis entre sí y E tiene los grupos de mayor prioridad trans entre sí. Si una configuración molecular se denomina E o Z está determinada por las reglas del CIP; A los números atómicos más altos se les da mayor prioridad. Para cada uno de los dos átomos del doble enlace, es necesario determinar la prioridad de cada sustituyente. Si ambos sustituyentes de mayor prioridad están en el mismo lado, la disposición es Z ; si están en lados opuestos, la disposición es E .
Debido a que los sistemas cis – trans y E – Z comparan diferentes grupos en el alqueno, no es estrictamente cierto que Z corresponda a cis y E corresponda a trans . Por ejemplo, trans -2-clorobut-2-eno (los dos grupos metilo, C1 y C4, en la cadena principal de but-2-eno son trans entre sí) es ( Z )-2-clorobut-2-eno (el el cloro y el C4 están juntos porque C1 y C4 son opuestos).
Los enlaces simples ondulados son la forma estándar de representar una estereoquímica desconocida o no especificada o una mezcla de isómeros (como ocurre con los estereocentros tetraédricos). A veces se ha utilizado un doble enlace cruzado; La IUPAC ya no lo considera un estilo aceptable para uso general , pero aún puede ser requerido por el software de computadora. [12]
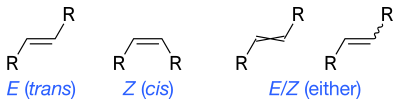
La isomería cis - trans también puede ocurrir en compuestos inorgánicos.
Los diazenos (y los difosfenos relacionados ) también pueden exhibir isomería cis - trans . Al igual que con los compuestos orgánicos, el isómero cis es generalmente el más reactivo de los dos, siendo el único isómero que puede reducir alquenos y alquinos a alcanos , pero por una razón diferente: el isómero trans no puede alinear sus hidrógenos adecuadamente para reducir el alqueno. pero el isómero cis , al tener una forma diferente, sí puede hacerlo.
Los complejos de coordinación con geometrías planas octaédricas o cuadradas también pueden exhibir isomería cis-trans .
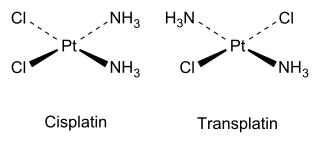
Por ejemplo, hay dos isómeros del Pt(NH 3 ) 2 Cl 2 plano cuadrado , como lo explicó Alfred Werner en 1893. El isómero cis , cuyo nombre completo es cis -diaminodicloroplatino (II), fue demostrado en 1969 por Barnett Rosenberg como tiene actividad antitumoral y ahora es un fármaco de quimioterapia conocido con el nombre corto de cisplatino . Por el contrario, el isómero trans ( transplatino ) no tiene actividad anticancerígena útil. Cada isómero se puede sintetizar utilizando el efecto trans para controlar qué isómero se produce.
Para los complejos octaédricos de fórmula MX 4 Y 2 , también existen dos isómeros. (Aquí M es un átomo de metal, y X e Y son dos tipos diferentes de ligandos ). En el isómero cis , los dos ligandos Y son adyacentes entre sí a 90°, como ocurre con los dos átomos de cloro que se muestran en verde en cis -[Co(NH 3 ) 4 Cl 2 ] + , a la izquierda. En el isómero trans que se muestra a la derecha, los dos átomos de Cl están en lados opuestos del átomo de Co central.
Un tipo relacionado de isomería en los complejos octaédricos MX 3 Y 3 es la isomería facial-meridional (o fac – mer ), en la que diferentes números de ligandos son cis o trans entre sí. Los compuestos de carbonilo metálico se pueden caracterizar como fac o mer mediante espectroscopia infrarroja .