
Una enamina es un compuesto insaturado derivado de la condensación de un aldehído o cetona con una amina secundaria . [1] [2] Las enaminas son intermediarios versátiles. [3] [4]
La palabra "enamina" se deriva del afijo en -, usado como sufijo de alqueno , y de la raíz amina . Esto se puede comparar con enol , que es un grupo funcional que contiene tanto alqueno ( en -) como alcohol (- ol ). Las enaminas se consideran análogos nitrogenados de los enoles. [6]
Si uno o ambos sustituyentes de nitrógeno son átomos de hidrógeno, se trata de la forma tautomérica de una imina . Por lo general, esto se reorganizará en la imina; sin embargo, hay varias excepciones (como la anilina ). La tautomería enamina-imina puede considerarse análoga a la tautomería ceto-enólica . En ambos casos, un átomo de hidrógeno cambia su ubicación entre el heteroátomo (oxígeno o nitrógeno) y el segundo átomo de carbono.
Las enaminas son buenos nucleófilos y buenas bases. Su comportamiento como nucleófilos basados en carbono se explica con referencia a las siguientes estructuras de resonancia.
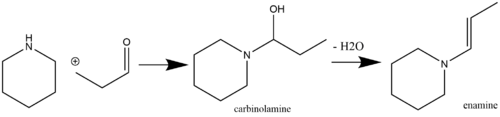
Las enaminas son fracciones lábiles y, por lo tanto, químicamente útiles que se pueden producir fácilmente a partir de reactivos de partida disponibles comercialmente. Una ruta común para la producción de enaminas es a través de una reacción nucleofílica catalizada por ácido de especies de cetona [7] o aldehído [8] que contienen un α-hidrógeno con aminas secundarias. La catálisis ácida no siempre es necesaria, si el pKaH de la amina que reacciona es suficientemente alto (por ejemplo, pirrolidina , que tiene un pKaH de 11,26). Sin embargo, si el pKaH de la amina que reacciona es bajo, entonces se requiere catálisis ácida a través de los pasos de adición y deshidratación [9] ( los agentes deshidratantes comunes incluyen MgSO4 y Na2SO4 ) . [10] Las aminas primarias generalmente no se utilizan para la síntesis de enaminas debido a la formación preferencial de las especies de imina más estables termodinámicamente . [11] La autocondensación de la metilcetona es una reacción secundaria que se puede evitar mediante la adición de TiCl 4 [12] a la mezcla de reacción (para que actúe como eliminador de agua ). [13] [14] A continuación se muestra un ejemplo de un aldehído que reacciona con una amina secundaria para formar una enamina a través de un intermedio de carbinolamina :
Aunque las enaminas son más nucleófilas que sus contrapartes enólicas, aún pueden reaccionar selectivamente, lo que las hace útiles para reacciones de alquilación. El nucleófilo de enamina puede atacar a los haloalcanos para formar el intermedio de sal de iminio alquilada que luego se hidroliza para regenerar una cetona (un material de partida en la síntesis de enamina). Esta reacción fue iniciada por Gilbert Stork , y a veces se hace referencia a ella por el nombre de su inventor (la alquilación de enamina de Stork ). Análogamente, esta reacción puede usarse como un medio eficaz de acilación . En esta reacción se pueden usar una variedad de agentes alquilantes y acilantes, incluidos haluros bencílicos y alílicos. [15]

En una reacción muy similar a la alquilación de enaminas, las enaminas pueden acilarse para formar un producto final de dicarbonilo . El material de partida de enaminas sufre una adición nucleofílica a haluros de acilo que forman el intermedio de sal de iminio que puede hidrolizarse en presencia de ácido. [16]

Las bases fuertes como LiNR2 se pueden utilizar para desprotonar iminas y formar metaloenaminas. Las metaloenaminas pueden resultar sintéticamente útiles debido a su nucleofilia (son más nucleófilas que los enolatos). Por lo tanto, son más capaces de reaccionar con electrófilos más débiles (por ejemplo, se pueden utilizar para abrir epóxidos . [ 17] ) Lo más destacado es que estas reacciones han permitido alquilaciones asimétricas de cetonas a través de la transformación a metaloenaminas intermedias quirales. [18]
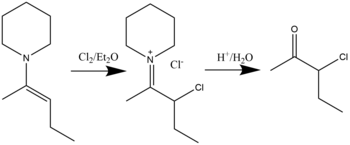
Los compuestos de β-halo imonio se pueden sintetizar mediante la reacción de halogenación de enaminas con haluros en un disolvente de éter dietílico . La hidrólisis dará como resultado la formación de α-halo cetonas. [19] Se ha demostrado que es posible la cloración, la bromación e incluso la yodación. La reacción general se muestra a continuación:
Las enaminas se pueden acoplar de forma cruzada de manera eficiente con silanos enólicos mediante el tratamiento con nitrato de amonio cérico . Estas reacciones fueron reportadas por el grupo Narasaka en 1975, proporcionando una ruta a enaminas estables, así como un caso de una 1,4-dicetona (derivada de un reactivo de amina de morfolina ). [20] Más tarde, estos resultados fueron explotados por el grupo MacMillan con el desarrollo de un organocatalizador que utilizó los sustratos de Narasaka para producir 1,4 dicarbonilos enantioselectivamente, con buenos rendimientos. [21] La dimerización oxidativa de aldehídos en presencia de aminas procede a través de la formación de una enamina seguida de una formación final de pirrol . [22] Este método para la síntesis simétrica de pirrol fue desarrollado en 2010 por el grupo Jia, como una nueva vía valiosa para la síntesis de productos naturales que contienen pirrol. [23]
La química de las enaminas se ha implementado con el propósito de producir una versión enantioselectiva de la anulación de Robinson en un solo paso . La anulación de Robinson, publicada por Robert Robinson en 1935, es una reacción catalizada por una base que combina una cetona y una metil vinil cetona (comúnmente abreviada como MVK) para formar un sistema de anillo fusionado con ciclohexenona . Esta reacción puede ser catalizada por prolina para proceder a través de intermediarios de enamina quirales que permiten una buena estereoselectividad. [24] Esto es importante, en particular en el campo de la síntesis de productos naturales, por ejemplo, para la síntesis de la cetona de Wieland-Miescher , un componente fundamental para moléculas biológicamente activas más complejas. [25] [26]
Las enaminas actúan como nucleófilos que requieren menos activación ácido/base para la reactividad que sus contrapartes enolato. También se ha demostrado que ofrecen una mayor selectividad con menos reacciones secundarias. Existe un gradiente de reactividad entre los diferentes tipos de enaminas, con una mayor reactividad ofrecida por las enaminas cetónicas que sus contrapartes aldehídos. [27] Las enaminas cetónicas cíclicas siguen una tendencia de reactividad donde el anillo de cinco miembros es el más reactivo debido a su conformación máximamente plana en el nitrógeno, siguiendo la tendencia 5>8>6>7 (el anillo de siete miembros es el menos reactivo). Esta tendencia se ha atribuido a la cantidad de carácter p en el orbital de par solitario del nitrógeno: el carácter p más alto corresponde a una mayor nucleofilia porque el orbital p permitiría la donación al orbital π del alqueno. De manera análoga, si el par solitario N participa en interacciones estereoelectrónicas en la fracción amina, el par solitario saldrá del plano (se piramidalizará ) y comprometerá la donación en el enlace π CC adyacente. [28] [29]

Existen muchas maneras de modular la reactividad de las enaminas, además de alterar la composición estérica/electrónica en el centro de nitrógeno, incluyendo cambios de temperatura, solvente, cantidades de otros reactivos y tipo de electrófilo. Ajustar estos parámetros permite la formación preferencial de enaminas E/Z y también afecta la formación de enaminas más/menos sustituidas a partir del material de partida cetónico. [30]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ); Volúmenes recopilados , vol. 5, pág. 1014.