En química , un electrófilo es una especie química que forma enlaces con nucleófilos al aceptar un par de electrones . [1] Debido a que los electrófilos aceptan electrones, son ácidos de Lewis . [2] La mayoría de los electrófilos tienen carga positiva , tienen un átomo que lleva una carga positiva parcial o tienen un átomo que no tiene un octeto de electrones.
Los electrófilos interactúan principalmente con los nucleófilos a través de reacciones de adición y sustitución . Los electrófilos que se ven con frecuencia en las síntesis orgánicas incluyen cationes como H + y NO + , moléculas neutras polarizadas como HCl , haluros de alquilo , haluros de acilo y compuestos carbonílicos , moléculas neutras polarizables como Cl 2 y Br 2 , agentes oxidantes como perácidos orgánicos , especies químicas que no satisfacen la regla del octeto como carbenos y radicales , y algunos ácidos de Lewis como BH 3 y DIBAL .
Estas reacciones se dan entre alquenos y electrófilos, a menudo halógenos, como en las reacciones de adición de halógenos . Las reacciones comunes incluyen el uso de agua de bromo para titular frente a una muestra y deducir la cantidad de enlaces dobles presentes. Por ejemplo, eteno + bromo → 1,2-dibromoetano :
Esto toma la forma de tres pasos principales que se muestran a continuación: [3]
Este proceso se denomina mecanismo Ad E 2 ("adición, electrófila, de segundo orden"). El yodo (I 2 ), el cloro (Cl 2 ), el ion sulfenilo (RS + ), el catión mercurio (Hg 2+ ) y el diclorocarbeno (:CCl 2 ) también reaccionan a través de vías similares. La conversión directa de 1 a 3 aparecerá cuando el Br − sea un gran exceso en el medio de reacción. Un intermedio de ion β-bromo carbenio puede ser predominante en lugar de 3 si el alqueno tiene un sustituyente estabilizador de cationes como el grupo fenilo. Hay un ejemplo del aislamiento del ion bromonio 2 . [4]
Los haluros de hidrógeno, como el cloruro de hidrógeno (HCl), se añaden a los alquenos para formar haluros de alquilo en la hidrohalogenación . Por ejemplo, la reacción de HCl con etileno produce cloroetano. La reacción se lleva a cabo con un intermediario catiónico, que es diferente de la adición de halógenos mencionada anteriormente. A continuación se muestra un ejemplo:
De esta manera, la estereoselectividad del producto, es decir, desde qué lado atacará el Cl −, depende de los tipos de alquenos aplicados y de las condiciones de la reacción. Al menos, cuál de los dos átomos de carbono será atacado por H + se decide generalmente mediante la regla de Markovnikov . Por lo tanto, H + ataca al átomo de carbono que lleva menos sustituyentes, de modo que se formará el carbocatión más estabilizado (con los sustituyentes más estabilizadores).
Este es otro ejemplo de un mecanismo Ad E 2 . [5] El fluoruro de hidrógeno (HF) y el yoduro de hidrógeno (HI) reaccionan con alquenos de una manera similar, y se darán productos de tipo Markovnikov. El bromuro de hidrógeno (HBr) también toma esta vía, pero a veces un proceso radical compite y se puede formar una mezcla de isómeros. Aunque los libros de texto introductorios rara vez mencionan esta alternativa, [6] el mecanismo Ad E 2 es generalmente competitivo con el mecanismo Ad E 3 (descrito con más detalle para alquinos, a continuación), en el que la transferencia del protón y la adición nucleofílica ocurren de manera concertada. El grado en que cada vía contribuye depende de varios factores como la naturaleza del disolvente (por ejemplo, polaridad), nucleofilia del ion haluro, estabilidad del carbocatión y efectos estéricos. Como ejemplos breves, la formación de un carbocatión estabilizado y libre de impedimentos estéricos favorece la vía Ad E 2, mientras que un ion bromuro más nucleófilo favorece la vía Ad E 3 en mayor medida en comparación con las reacciones que involucran al ion cloruro. [7]
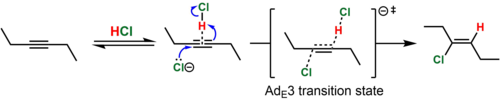
En el caso de alquinos sustituidos con dialquilo (por ejemplo, 3-hexino), el catión vinilo intermedio que resultaría de este proceso es altamente inestable. En tales casos, se cree que tiene lugar la protonación simultánea (por HCl) y el ataque del alquino por el nucleófilo (Cl − ). Esta vía mecanicista se conoce por la etiqueta de Ingold Ad E 3 ("adición, electrofílica, de tercer orden"). Debido a que la colisión simultánea de tres especies químicas en una orientación reactiva es improbable, se cree que el estado de transición termolecular se alcanza cuando el nucleófilo ataca una asociación débil formada reversiblemente del alquino y HCl. Tal mecanismo es consistente con la adición predominantemente anti (>15:1 anti : syn para el ejemplo mostrado) del producto de hidrocloración y la ley de velocidad termolecular, Velocidad = k [alquino][HCl] 2 . [8] [9] En apoyo de la asociación alquino-HCl propuesta, se ha caracterizado cristalográficamente un complejo en forma de T de un alquino y HCl. [10]
Por el contrario, el fenilpropino reacciona mediante el mecanismo Ad E 2 ip ("adición, electrófilo, segundo orden, par iónico") para dar predominantemente el producto syn (~10:1 syn : anti ). En este caso, el catión vinilo intermedio se forma mediante la adición de HCl porque está estabilizado por resonancia por el grupo fenilo. Sin embargo, la vida útil de esta especie de alta energía es corta, y el par iónico resultante formado por el catión vinilo y el anión cloruro colapsa inmediatamente, antes de que el ión cloruro tenga la oportunidad de abandonar la capa del disolvente, para dar el cloruro de vinilo. La proximidad del anión al lado del catión vinilo donde se añadió el protón se utiliza para racionalizar el predominio observado de la adición syn . [7]

Una de las reacciones de hidratación más complejas utiliza ácido sulfúrico como catalizador . Esta reacción se produce de forma similar a la reacción de adición, pero tiene un paso adicional en el que el grupo OSO 3 H se reemplaza por un grupo OH, formando un alcohol:
Como se puede observar, el H 2 SO 4 participa en la reacción general, sin embargo permanece inalterado, por lo que se clasifica como catalizador.
Esta es la reacción con más detalle:
En general, este proceso agrega una molécula de agua a una molécula de eteno.
Esta es una reacción importante en la industria, ya que produce etanol , cuyos usos incluyen combustibles y materia prima para otros productos químicos.
Muchos electrófilos son quirales y ópticamente estables . Por lo general, los electrófilos quirales también son ópticamente puros.
Uno de estos reactivos es el organocatalizador derivado de fructosa utilizado en la epoxidación de Shi . [11] El catalizador puede lograr epoxidaciones altamente enantioselectivas de alquenos trans -disustituidos y trisustituidos . El catalizador Shi, una cetona , se oxida mediante oxona estequiométrica a la forma activa de dioxirano antes de continuar en el ciclo catalítico.

Las oxaziridinas, como las N-sulfoniloxaziridinas quirales , efectúan una oxidación alfa enantioselectiva de cetonas en ruta a los segmentos del anillo AB de varios productos naturales , entre ellos la γ-rodomicionona y la α-citromicinana. [12]
Los electrófilos de selenio quirales unidos a polímeros efectúan reacciones de selenenilación asimétrica. [13] Los reactivos son bromuros de selenenilo de arilo, y fueron desarrollados primero para la química en fase de solución y luego modificados para la unión de perlas en fase sólida a través de una fracción ariloxi. Los reactivos en fase sólida se aplicaron para la selenenilación de varios alquenos con buenas enantioselectividades. Los productos se pueden escindir del soporte sólido utilizando agentes reductores de hidruro de organoestaño . Los reactivos con soporte sólido ofrecen ventajas sobre la química en fase de solución debido a la facilidad de procesamiento y purificación.
Existen varios métodos para clasificar a los electrófilos en orden de reactividad [15] y uno de ellos fue ideado por Robert Parr [14] con el índice de electrofilicidad ω dado como:
con la electronegatividad y dureza química . Esta ecuación está relacionada con la ecuación clásica de potencia eléctrica :
donde es la resistencia ( Ohm o Ω) y es el voltaje . En este sentido, el índice de electrofilia es una especie de potencia electrofílica. Se han encontrado correlaciones entre la electrofilia de varios compuestos químicos y las velocidades de reacción en sistemas bioquímicos y fenómenos como la dermatitis alérgica de contacto.
También existe un índice de electrofilicidad para los radicales libres . [16] Los radicales fuertemente electrofílicos como los halógenos reaccionan con sitios de reacción ricos en electrones, y los radicales fuertemente nucleofílicos como el radical 2-hidroxipropil-2-ilo y el radical terc-butilo reaccionan con preferencia por sitios de reacción pobres en electrones.
Los superelectrófilos se definen como reactivos electrófilos catiónicos con reactividades muy mejoradas en presencia de superácidos . Estos compuestos fueron descritos por primera vez por George A. Olah . [17] Los superelectrófilos se forman como un superelectrófilo doblemente deficiente en electrones por protosolvatación de un electrófilo catiónico. Como observó Olah, una mezcla de ácido acético y trifluoruro de boro es capaz de eliminar un ion hidruro del isobutano cuando se combina con ácido fluorhídrico a través de la formación de un superácido a partir de BF3 y HF . El intermediario reactivo responsable es el dicatión [ CH3CO2H3 ] 2+ . Del mismo modo, el metano se puede nitrar a nitrometano con tetrafluoroborato de nitronio NO+
2BF−
4sólo en presencia de un ácido fuerte como el ácido fluorosulfúrico a través del dicatión de nitronio protonado.
En los superelectrófilos gitiónicos ( gitónicos ), los centros cargados están separados por no más de un átomo, por ejemplo, el ion protonitronio O=N + =O + —H (un ion nitronio protonado ). Y, en los superelectrófilos distónicos , están separados por 2 o más átomos, por ejemplo, en el reactivo de fluoración F-TEDA-BF 4 . [18]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )