Trichuris trichiura , Trichocephalus trichiuris o tricocéfalo , es un gusano redondo parásito (un tipo de helminto ) que causa tricuriasis (un tipo de helmintiasis que es una de las enfermedades tropicales desatendidas ) cuando infecta el intestino grueso humano . Se lo conoce comúnmente como tricocéfalo , lo que hace referencia a la forma del gusano; parece un látigo con "asas" más anchas en el extremo posterior. [2] También se sabe que el helminto causa prolapso rectal .
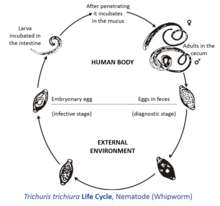
La hembra de T. trichiura produce entre 2.000 y 10.000 huevos unicelulares al día. [3] Los huevos se depositan desde las heces humanas al suelo donde, después de dos o tres semanas, se embrionan y entran en la etapa "infectiva". Estos huevos infectivos embrionados se ingieren con la mano-boca o a través de fómites y eclosionan en el intestino delgado humano , explotando la microflora intestinal como estímulo para la eclosión. [4] Este es el lugar de crecimiento y muda. Las larvas infecciosas penetran las vellosidades y continúan desarrollándose en el intestino delgado. Los gusanos jóvenes se mueven al ciego y penetran en la mucosa , y allí completan el desarrollo como gusanos adultos en el intestino grueso . El ciclo de vida desde el momento de la ingestión de los huevos hasta el desarrollo de los gusanos maduros dura aproximadamente tres meses. Durante este tiempo, puede haber signos limitados de infección en las muestras de heces, debido a la falta de producción y desprendimiento de huevos. La hembra de T. trichiura comienza a poner huevos después de tres meses de madurez. Los gusanos suelen vivir alrededor de un año, [5] durante el cual las hembras pueden poner hasta 20.000 huevos por día.
Estudios recientes que utilizan escaneo de todo el genoma revelaron que dos loci de rasgos cuantitativos en el cromosoma 9 y el cromosoma 18 pueden ser responsables de una predisposición genética o susceptibilidad a la infección de T. trichiura en algunos individuos. [6]


Trichuris trichiura tiene un extremo esofágico anterior estrecho y un extremo posterior más corto y grueso. Estos gusanos de color blanco rosado se enroscan a través de la mucosa . Se adhieren al huésped a través de su extremo anterior delgado y se alimentan de secreciones de tejido en lugar de sangre. Las hembras son más grandes que los machos; aproximadamente 35-50 mm de largo en comparación con 30-45 mm. [7] Las hembras tienen un extremo posterior romamente redondeado en comparación con sus contrapartes masculinas con un extremo posterior enrollado. Sus huevos característicos tienen forma de barril y son marrones, y tienen protuberancias bipolares.
La tricocéfalosis , también conocida como infección por tricocéfalo, se produce por la ingestión de huevos de tricocéfalo y es más común en climas más cálidos. Los huevos de tricocéfalo pasan a través de las heces de personas infectadas, y si una persona infectada defeca al aire libre o si se utilizan heces humanas no tratadas como fertilizante, los huevos se depositan en el suelo donde pueden madurar hasta una etapa infecciosa. [5] La ingestión de estos huevos "puede ocurrir cuando las manos o los dedos que tienen tierra contaminada se llevan a la boca o al consumir verduras o frutas que no han sido cuidadosamente cocinadas, lavadas o peladas". [5] Los huevos eclosionan en el intestino delgado, luego se mueven hacia la pared del intestino delgado y se desarrollan. Al llegar a la edad adulta, el extremo más delgado (la parte anterior del gusano) excava en el intestino grueso, mientras que el extremo más grueso (posterior) se proyecta hacia el lumen , donde se aparea con los gusanos cercanos. Las hembras pueden crecer hasta 50 mm (2,0 pulgadas) de largo. [3]
Trichuris trichiura puede causar una enfermedad grave, el síndrome de disentería Trichuris (SDT), que se caracteriza por disentería crónica, anemia, prolapso rectal y retraso del crecimiento. [8] El SDT se trata con antihelmínticos y suplementos de hierro para la anemia. [9]
El tricocéfalo comúnmente infecta a pacientes también infectados con Giardia , Entamoeba histolytica , Ascaris lumbricoides y anquilostomas . [10]
El Trichuris trichiura puede tratarse con una dosis única de albendazol . [11] En Kenia, a la mitad de un grupo de niños, el 98% de los cuales tenían Trichuris trichiura con o sin infecciones por otros helmintos transmitidos por el suelo , se les administró albendazol, mientras que la otra mitad de los niños recibió placebos. Se encontró que los niños que recibieron el fármaco crecieron significativamente mejor que el grupo de niños que no recibieron el tratamiento. [12] Otro tratamiento que se puede utilizar es el mebendazol o flubendazol . [13] El medicamento interfiere con la ingesta de nutrientes del parásito, lo que finalmente conduce a la muerte.
Sin embargo, se ha demostrado que tanto el albendazol como el mebendazol tienen una baja tasa de curación para Trichuris thrichiura específicamente, y los tratamientos solo logran tasas de curación del 30,7% para el albendazol y del 42,1% para el mebendazol. [14]
Existe una distribución mundial de Trichuris trichiura , con un estimado de mil millones de infecciones humanas. [15] [16] [17] [8] Sin embargo, es principalmente tropical, especialmente en Asia y, en menor grado, en África y Sudamérica. Dentro de los Estados Unidos, la infección es rara en general, pero puede ser común en el sudeste rural, donde se cree que 2,2 millones de personas están infectadas. La mala higiene se asocia con la tricuriasis , así como el consumo de tierra húmeda a la sombra o alimentos que pueden haber sido contaminados con heces. Los niños son especialmente vulnerables a la infección debido a su alto riesgo de exposición. Los huevos son infecciosos aproximadamente 2 a 3 semanas después de que se depositan en el suelo en condiciones adecuadas de calor y humedad, de ahí su distribución tropical.
Una especie estrechamente relacionada, Trichuris suis , que normalmente infecta a los cerdos, es capaz de infectar a los humanos. Esto demuestra que las dos especies tienen historias evolutivas muy cercanas. Sin embargo, la morfología y las etapas de desarrollo siguen siendo diferentes, lo que las convierte en dos especies distintas. [18]
Desde 2001, la OMS cuenta con una estrategia para el control de las helmintiasis transmitidas por el suelo, incluidas las tricocéfalas, que supone el tratamiento de las personas en riesgo en las zonas endémicas. Los grupos de riesgo de infecciones por tricocéfalos son los niños en edad preescolar y escolar, las personas con trabajos específicos de alto riesgo, las mujeres en edad reproductiva y las mujeres embarazadas y lactantes. El tratamiento periódico de los grupos de riesgo se realiza mediante campañas de desparasitación o quimioterapia preventiva. [19]
La hipótesis de la higiene sugiere que varios trastornos inmunológicos que se han observado en humanos solo en los últimos 100 años, como la enfermedad de Crohn , o que se han vuelto más comunes durante ese período a medida que las prácticas higiénicas se han generalizado, pueden ser resultado de una falta de exposición a gusanos parásitos ( helmintos ) durante la infancia. El uso de huevos de Trichuris suis (TSO, o huevos de tricocéfalo del cerdo) por Weinstock, et al., como terapia para tratar la enfermedad de Crohn [20] [21] [22] y en menor medida la colitis ulcerosa [23] son dos ejemplos que apoyan esta hipótesis. También hay evidencia anecdótica de que el tratamiento de la enfermedad inflamatoria intestinal (EII) con TSO disminuye la incidencia de asma , [24] [¿ fuente autopublicada? ] alergia , [25] y otros trastornos inflamatorios. [26] Algunas evidencias científicas sugieren que el curso de la esclerosis múltiple puede ser alterado muy favorablemente por la infección por helmintos; [27] Se está estudiando el TSO como tratamiento para esta enfermedad. [28] [29]
{{cite journal}}: CS1 maint: DOI inactivo a partir de noviembre de 2024 ( enlace )En nuestro paciente, las células Treg [células T reguladoras] activadas por helmintosis [infestación por T. suis] fueron probablemente el elemento clave que protegía a un huésped con colitis ulcerosa latente contra el desarrollo de una protococolitis grave. (1183)
Caroline Pomeroy, PhD 9 de julio de 2019.