Tiazol ( / ˈ θ aɪ . ə z oʊ l / ), o 1,3-tiazol , es un compuesto heterocíclico de 5 miembros que contiene azufre y nitrógeno. El término 'tiazol' también hace referencia a una gran familia de derivados. El tiazol en sí es un líquido de color amarillo pálido con olor a piridina y fórmula molecular C 3 H 3 NS. [2] El anillo de tiazol destaca como componente de la vitamina tiamina (B 1 ).
Los tiazoles son miembros de los azoles , heterociclos que incluyen imidazoles y oxazoles . El tiazol también puede considerarse un grupo funcional cuando forma parte de una molécula más grande.
Al ser tiazoles planos, se caracterizan por una importante deslocalización del electrón pi y tienen cierto grado de aromaticidad , más que los correspondientes oxazoles . Esta aromaticidad se evidencia por el desplazamiento químico de 1 H NMR de los protones del anillo, que absorben entre 7,27 y 8,77 ppm, lo que indica una fuerte corriente diamagnética del anillo . La densidad de electrones pi calculada marca a C5 como el sitio principal para la sustitución electrófila y a C2-H como susceptible a la desprotonación.
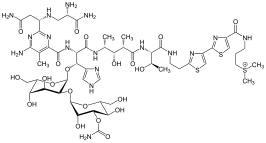
Los tiazoles se encuentran en una variedad de productos especializados, a menudo fusionados con derivados del benceno, los llamados benzotiazoles. Además de la vitamina B1 , la epotilona contiene el anillo de tiazol . Otros derivados importantes del tiazol son los benzotiazoles , por ejemplo, el químico luciérnaga luciferina . Mientras que los tiazoles están bien representados en las biomoléculas , los oxazoles no. Se encuentra en péptidos naturales y se utiliza en el desarrollo de peptidomiméticos (es decir, moléculas que imitan la función y estructura de los péptidos). [3]
Los tiazoles comerciales importantes incluyen principalmente colorantes y fungicidas . La tifluzamida, el triciclazol y el tiabendazol se comercializan para el control de diversas plagas agrícolas. Otro derivado de tiazol muy utilizado es el fármaco antiinflamatorio no esteroideo Meloxicam . Los siguientes colorantes de antroquinona contienen subunidades de benzotiazol: Algol Yellow 8 (CAS# [6451-12-3]), Algol Yellow GC (CAS# [129-09-9]), Indanthren Rubine B (CAS# [6371-49-9] ]), Indanthren Blue CLG (CAS# [6371-50-2] y Indanthren Blue CLB (CAS#[6492-78-0]). Estos tintes de tiazol se utilizan para teñir algodón .
Existen varios métodos de laboratorio para la síntesis orgánica de tiazoles. Destaca la síntesis de tiazol de Hantzsch, que es una reacción entre halocetonas y tioamidas . Por ejemplo, el 2,4-dimetiltiazol se sintetiza a partir de tioacetamida y cloroacetona . [4] En la síntesis de Cook-Heilbron , los tiazoles surgen por la condensación de α-aminonitrilo con disulfuro de carbono . Se puede acceder a los tiazoles mediante la acilación de 2-aminotiolatos, a menudo disponibles mediante la reacción de Herz .
Los tiazoles generalmente se forman mediante reacciones de cisteína , que proporciona la columna vertebral NCCS del anillo. Sin embargo, la tiamina no se ajusta a este patrón. Varias rutas de biosíntesis conducen al anillo de tiazol necesario para la formación de tiamina. [5] El azufre del tiazol se deriva de la cisteína. En las bacterias anaeróbicas, el grupo CN se deriva de la deshidroglicina.
Con un pKa de 2,5 para el ácido conjugado, los tiazoles son mucho menos básicos que el imidazol (pKa = 7). [6]
La desprotonación con bases fuertes ocurre en C2-H. La carga negativa en esta posición se estabiliza como un iluro . Las bases de Hauser y los compuestos organolitíicos reaccionan en este sitio, reemplazando al protón. Los 2-litiotiazoles también se generan mediante el intercambio de metal-halógeno a partir del 2-bromotiazol. [7]
Sustitución aromática electrófila en C5 pero requiere grupos activadores como un grupo metilo , como se ilustra en la bromación :
La oxidación en nitrógeno da el N -óxido de tiazol aromático ; existen muchos agentes oxidantes, como el mCPBA ; uno novedoso es el ácido hipofluoroso preparado a partir de flúor y agua en acetonitrilo ; parte de la oxidación tiene lugar en el azufre, lo que da lugar a sulfóxido / sulfona no aromáticos : [8] Los N -óxidos de tiazol son útiles en arilaciones de CH catalizadas por paladio, donde el N -óxido puede cambiar la reactividad para favorecer de manera confiable la 2 -posición, y permite que estas reacciones se lleven a cabo en condiciones mucho más suaves. [9]
La alquilación de tiazoles en nitrógeno forma un catión tiazolio . Las sales de tiazolio son catalizadores de la reacción de Stetter y de la condensación de benjuí . La desprotonación de las sales de N -alquiltiazolio da los carbenos libres [11] y complejos de carbeno de metales de transición .
Alagebrium es un fármaco a base de tiazolio.
{{cite journal}}: Citar diario requiere |journal=( ayuda )