El sarcoma de células dendríticas foliculares (FDCS) es una neoplasia extremadamente rara . Si bien Lennert predijo la existencia de tumores FDC en 1978, el tumor no fue reconocido completamente como un cáncer en sí mismo hasta 1986 después de la caracterización de Monda et al. [1] [2] Representa solo el 0,4 % de los sarcomas de tejidos blandos , pero tiene un potencial recurrente y metastásico significativo y se considera una neoplasia maligna de grado intermedio. [3] El principal obstáculo en el tratamiento del FDCS ha sido el diagnóstico erróneo. Es un cáncer recientemente caracterizado y, debido a sus similitudes en la presentación y los marcadores con el linfoma , tanto de subtipo Hodgkin como no Hodgkin, el diagnóstico de FDCS puede ser difícil. [4] Con los avances recientes en la biología del cáncer, se han realizado mejores ensayos de diagnóstico y agentes quimioterapéuticos para diagnosticar y tratar con mayor precisión el FDCS. [ cita requerida ]
Las células dendríticas foliculares se localizan en los centros germinales de los folículos linfoides y tienen un papel integral en la regulación de la reacción del centro germinal y presentan antígenos a las células B. [5] [6] La mayoría de los casos de FDCS se desarrollan en los ganglios linfáticos, pero alrededor del 30% se desarrollan en sitios extranodales. En 1998, el estudio más grande sobre la enfermedad fue una revisión retrospectiva con cincuenta y un pacientes. [7] De estos cincuenta y un pacientes, no se encontró un patrón concluyente con respecto a la edad, el sexo, la raza o la presentación. La edad media de los pacientes fue de 41 años (rango 14-76), y mientras que la mayoría de los casos se presentaron con linfadenopatía cervical y axilar , 17 se presentaron en sitios extranodales incluyendo el hígado, el bazo, el intestino y el páncreas. [7] Con tal rango de historias de pacientes, no se ha vinculado ninguna causa definitiva con FDCS. Sin embargo, ha habido alguna evidencia de que la exposición previa al virus de Epstein-Barr (VEB) o el diagnóstico de la enfermedad de Castleman pueden aumentar el riesgo de desarrollar sarcoma de FDC. La literatura médica en 2000 informó que aproximadamente el 12 % de todos los casos de tumores de FDC están asociados con el VEB, con variación en diferentes órganos, pero el papel del VEB sigue sin estar claro en la patogénesis del tumor de FDC; y el VEB no parece desempeñar un papel en el proceso de transformación de la enfermedad de Castleman en sarcoma de FDC porque todos los casos que el informe encontró asociados con la enfermedad de Castleman fueron negativos al VEB. [8] [9] [10]
Los síntomas del FDCS varían y dependen en gran medida de la parte del cuerpo en la que se desarrolla el tumor. El síntoma más común es la hinchazón indolora de los ganglios linfáticos. Sin embargo, este síntoma por sí solo no es concluyente, ya que está asociado con muchas otras enfermedades, incluido el resfriado común. Otros síntomas incluyen tos, dolor de garganta, dificultad para tragar, pérdida de peso y cansancio. En los casos que se presentan en sitios extraganglionares fuera de la región de la cabeza y el cuello, se observan síntomas específicos del órgano. [ cita requerida ]
La proliferación de células FDC es característica de muchas enfermedades neoplásicas, entre ellas la hiperplasia folicular , el linfoma folicular , la enfermedad de Hodgkin con predominio linfocítico nodular y el linfoma angioinmunoblástico de células T. [11] A pesar de que finalmente se reconoció como una enfermedad propia en 1986, el diagnóstico de FDCS sigue siendo difícil. Las células FDC son grandes, contienen dos núcleos y forman grupos con linfocitos, lo que hace que sea difícil distinguirlas en la tinción. Estas células se visualizan mejor con inmunotinción utilizando los marcadores FDC CD21, CD35, R4/23, clusterina y KiM4p. [11] El análisis de marcadores también ha dado lugar a un debate sobre el origen del tipo de célula; coexpresa CD45, un antígeno común de leucocitos, y CD15, un antígeno común de monocitos. [7] Debido al debate y la dificultad de la tinción, el diagnóstico patológico a menudo requiere también análisis morfológico, citoquímico y de microscopio electrónico. [7]
Las anomalías celulares encontradas dentro del tumor FDCS se han explotado con fines diagnósticos. Característicamente, los FDCS tienen estructuras microtubuloreticulares (MTRS) y mayores niveles de clusterina intracelular . [12] [13] Las MTRS contribuyen a la formación de microtúbulos de muchas estructuras, incluido el huso mitótico, durante la división celular. Esto contribuye a muchas de las características distintivas del cáncer, incluida la señalización proliferativa, la activación del crecimiento y la inmortalidad replicativa. [14] La clusterina es una proteína heterodímera que ayuda a la eliminación de restos celulares y está involucrada en la apoptosis. La clusterina se puede teñir para ayudar a distinguir los FDCS y está involucrada en muchas características distintivas importantes del cáncer, incluida la resistencia a la muerte celular y la evasión de los supresores del crecimiento. [14]
En el momento del descubrimiento del sarcoma de células dendríticas foliculares, no existía información sobre el efecto de la quimioterapia y la radiación en él. Lo mejor que podían hacer los médicos era probar los agentes quimioterapéuticos existentes. Sin evidencia del beneficio clínico de la quimioterapia, muchos de los primeros casos se trataron únicamente con resección completa y/o radiación. Sin embargo, 12 de 31 pacientes que se sometieron a cirugía únicamente como tratamiento primario sufrieron una recaída. [7] De los pacientes que recibieron cirugía y radiación, 2 de 8 sufrieron una recaída. [7] Se hizo evidente que eran necesarias mejores opciones de tratamiento. Al ser tan similar a los linfomas, los médicos comenzaron a utilizar un régimen de quimioterapia común para la leucemia y el linfoma no Hodgkin en pacientes con FDCS: CHOP . [ cita requerida ]

El régimen CHOP consiste en ciclofosfamida , doxorrubicina , oncovina y prednisona (CHOP). Todos ellos explotan diferentes vías comunes en las células cancerosas. La ciclofosfamida ralentiza o detiene el crecimiento celular. Se dirige a las células que se dividen rápidamente, que incluyen células cancerosas que son autosuficientes en señales de crecimiento e insensibles a las señales anticrecimiento. Más importante aún, las acciones biológicas de la ciclofosfamida dependen de la dosis. [15] En dosis altas es muy citotóxico; su metabolito fosforimida agrega un grupo alquilo a la posición N7 en la guanina, lo que resulta en la detención del crecimiento y la muerte celular. El metabolito solo se forma en células con niveles bajos de aldehído deshidrogenasa citoplasmática (ALDH), lo que resulta en una toxicidad quimioterapéutica relativamente baja en otras células no cancerosas como la médula ósea. También es un inmunosupresor y disminuye la respuesta inflamatoria. En dosis bajas, aunque es menos citotóxico, muestra algunas propiedades antiangiogénicas. El mecanismo no se comprende completamente; se cree que interfiere con los factores de crecimiento VEGF producidos en el microambiente tumoral y sus alrededores. [16]
La doxorrubicina interfiere en el crecimiento y replicación celular al intercalarse en el ADN. Esto evita que la topoisomerasa II relaje las cadenas de ADN e inhibe la transcripción. Estudios recientes también han demostrado que la doxorrubicina puede estar involucrada en la vía PI3K/AKT/mTOR . [17] Akt, un sello distintivo importante del cáncer, es parte de las vías de supervivencia celular al inhibir la apoptosis. También hay evidencia de que Akt está involucrada en la angiogénesis y la maduración vascular. [18] La activación de la vía PI3K/AKT/mTOR media la producción de VEGF en las células. [18] Por lo tanto, la doxorrubicina tiene un papel doble en el tratamiento del cáncer: inhibe la supervivencia celular (provoca apoptosis) y disminuye la angiogénesis. [ cita requerida ]
Oncovin, más comúnmente conocida como vincristina, es un inhibidor mitótico. Se une a los dímeros de tubulina, inhibiendo el ensamblaje de estructuras de microtúbulos como el citoesqueleto y el huso mitótico. Aunque este fármaco todavía no puede dirigirse estrictamente a las células cancerosas, estas tienen un recambio promedio más alto de microtúbulos, lo que las hace más susceptibles a la citotoxicidad de oncovin. La prednisona, el último fármaco de la terapia combinada CHOP, es un corticosteroide que actúa como inmunosupresor. [ cita requerida ]
Aunque se observaron algunos resultados en pacientes con FDCS tratados con CHOP, no fueron para nada consistentes. El uso de un régimen de quimioterapia diseñado para otro cáncer es una forma arcaica de "conjeturar y comprobar" de tratar una enfermedad. En 2008, se publicó la revisión más grande de FDCS como un análisis retrospectivo de 98 pacientes y los autores recomendaron que la cirugía sin tratamiento adyuvante fuera el estándar para el tratamiento con FDCS. [19] Los pacientes tratados solo con cirugía tuvieron una tasa de recurrencia del 40% y aquellos tratados con terapia adyuvante después de la cirugía no tuvieron una tasa de recurrencia significativamente diferente. [19] La radioterapia y/o quimioterapia no tuvieron un efecto significativo en la mejora de la supervivencia libre de enfermedad de los pacientes. Sin embargo, con los avances en nuestra comprensión de las características distintivas del cáncer, se están desarrollando nuevos enfoques para dirigirse específicamente a FDCS y tratarlo. [ cita requerida ]
Uno de estos avances es la administración de doxorrubicina. Si bien es un inductor eficaz de la apoptosis, la doxorrubicina se filtra rápidamente del cuerpo. Al cargar un liposoma de PEG con doxorrubicina, el tiempo de circulación y la localización en los tumores aumentan considerablemente. [3] Los tumores cancerosos se caracterizan por tener una angiogénesis extensa y vasculaturas permeables, lo que hace que los liposomas de PEG se acumulen naturalmente en el tumor. Esto también permite que los pacientes reciban dosis más bajas y menos numerosas del fármaco y experimenten menos efectos secundarios.

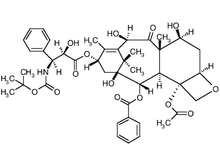
Los casos más recientes también están comenzando a ser tratados con taxotere y gemcitabina . Taxotere es similar a Oncovin utilizado en CHOP; se une irreversiblemente a la beta tubulina deteniendo la formación de microtúbulos. Sin embargo, Taxotere tiene un beneficio adicional; también fosforila bcl-2 para detener la vía antiapoptótica. [20] El doble efecto de taxotere en las vías integrales del cáncer lo convierte en un fármaco más potente que Oncovin. Gemcitabeno es un análogo de nucleósido y cuando se incorpora al ADN durante la replicación conduce a la apoptosis; el flúor en el átomo de carbono 2' evita que otros nucleósidos se adhieran. [21] Sin embargo, la parte más importante de esta terapia combinada es el sinergismo entre los fármacos. Si bien los investigadores no están completamente seguros del mecanismo, existe evidencia de efectos sinérgicos de taxotere y gemcitabina cuando se usan en combinación. [22] [23] Esto permite reducir las dosis de cada agente individual con una mayor respuesta apoptótica. [ cita requerida ]
Todos los avances en la comprensión y el tratamiento del FDCS provienen de los avances logrados en otros tipos de cáncer. Es difícil conseguir financiación para la investigación y, al ser un cáncer tan poco frecuente, el FDCS no recibe prioridad monetaria. CHOP, Gemcitabine y Taxotere se desarrollaron inicialmente para otros tipos de cáncer, pero las vías mutadas entre sí permiten su uso en el FDCS. Las características distintivas del cáncer han ayudado a los médicos a darse cuenta de que existen similitudes biológicas entre tipos de cáncer aparentemente muy diferentes que se pueden aprovechar para desarrollar nuevos y mejores planes de tratamiento. [14]