El queratán sulfato ( KS ), también llamado queratosulfato , es uno de varios glicosaminoglicanos sulfatados (carbohidratos estructurales) que se han encontrado especialmente en la córnea , el cartílago y el hueso . También se sintetiza en el sistema nervioso central , donde participa tanto en el desarrollo [1] como en la formación de cicatrices gliales después de una lesión. [2] Los queratán sulfatos son moléculas grandes y altamente hidratadas que en las articulaciones pueden actuar como un cojín para absorber el impacto mecánico .
Al igual que otros glicosaminoglicanos, el queratán sulfato es un polímero lineal que consiste en una unidad de disacárido repetida. El queratán sulfato se presenta como un proteoglicano (PG) en el que las cadenas de KS están unidas a proteínas de la superficie celular o de la matriz extracelular , denominadas proteínas centrales. Las proteínas centrales de KS incluyen lumican , queratocan , mimecan , fibromodulina , PRELP , osteoadherina y agrecano .
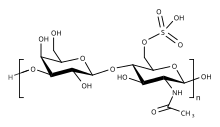
La unidad básica de disacárido repetitivo dentro del sulfato de queratán es -3 Gal β1-4 GlcNAc6S β1-. Esta puede estar sulfatada en la posición de carbono 6 (C6) de uno o ambos monosacáridos Gal o GlcNAc. Sin embargo, se considera mejor que la estructura primaria detallada de tipos específicos de KS está compuesta por tres regiones: [3]
El monosacárido manosa se encuentra dentro de la región de enlace del queratán sulfato tipo I (KSI). Los disacáridos dentro de la región repetitiva del KSII pueden estar fucosilados y el ácido N-acetilneuramínico recubre el extremo de todas las cadenas del queratán sulfato tipo II (KSII) y hasta el 70 % de las cadenas del tipo KSI. [4]
Las designaciones KSI y KSII se asignaron originalmente sobre la base del tipo de tejido del que se aisló el sulfato de queratán. KSI se aisló del tejido corneal y KSII del tejido esquelético . [5] [6] Existen pequeñas diferencias en la composición de monosacáridos entre el KS extraído de ambas fuentes e incluso el KS extraído de la misma fuente. Sin embargo, las diferencias principales ocurren en la forma en que cada tipo de KS se une a su proteína central. [7] Las designaciones KSI y KSII ahora se basan en estas diferencias de enlace de proteínas. KSI está N -ligado a aminoácidos específicos de asparagina a través de N -acetilglucosamina y KSII está O -ligado a aminoácidos específicos de serina o treonina a través de N -acetilgalactosamina . [8] La clasificación basada en tejidos de KS ya no existe ya que se ha demostrado que los tipos de KS no son específicos de tejido. [4] También se ha aislado un tercer tipo de KS (KSIII) del tejido cerebral que está unido a aminoácidos serina o treonina específicos a través de la manosa . [9]
La cantidad de queratán sulfato que se encuentra en la córnea es diez veces mayor que en el cartílago y de dos a cuatro veces mayor que en otros tejidos. [10] Es producido por los queratocitos corneales [11] y se cree que desempeña un papel de amortiguador dinámico de la hidratación corneal. En un trastorno progresivo poco frecuente llamado distrofia corneal macular (MCDC), la síntesis de queratán sulfato está ausente (MCDC tipo I) o es anormal (MCDC tipo II). [12]
La osteoadherina , la fibromodulina y la PRELP son proteínas centrales que se encuentran en el hueso y el cartílago y que están modificadas por cadenas de KS unidas a N. Las cadenas de KS unidas a osteoadherina y fibromodulina son más cortas que las que se encuentran en la córnea, normalmente de 8 a 9 unidades de disacárido de longitud. [13] Mientras que la KSI corneal está compuesta por una serie de dominios que muestran grados variables de sulfatación, el más largo de los cuales puede tener una longitud de 8 a 32 unidades de disacárido. La terminal no reductora de la fibromodulina KS es más similar en estructura a la terminal no reductora de un sulfato de queratán de tipo KSII que a la KSI corneal. Por lo tanto, se cree que la estructura de la KS está determinada por la disponibilidad específica del tejido de las glicosiltransferasas en lugar del tipo de enlace a la proteína central. [4]
El cartílago KSII está casi completamente sulfatado y consiste en monómeros disulfatados interrumpidos ocasionalmente por un único monómero de lactosamina monosulfatado. [8] La fucosilación también es común con fucosa ligada a alfa presente en la posición de carbono 3 de GlcNAc sulfatado , excepto en el caso del KSII traqueal donde esta característica está ausente.