La dieldrina es un compuesto organoclorado producido originalmente en 1948 por J. Hyman & Co, Denver, como insecticida . La dieldrina está estrechamente relacionada con la aldrina , que reacciona posteriormente para formar dieldrina. La aldrina no es tóxica para los insectos; se oxida en el insecto para formar dieldrina, que es el compuesto activo. Tanto la dieldrina como la aldrina reciben su nombre de la reacción de Diels-Alder que se utiliza para formar aldrina a partir de una mezcla de norbornadieno y hexaclorociclopentadieno .
Desarrollado originalmente en la década de 1940 como una alternativa al DDT , el dieldrín demostró ser un insecticida muy eficaz y fue ampliamente utilizado durante la década de 1950 y principios de la década de 1970. La endrina es un estereoisómero del dieldrín.
Sin embargo, es un contaminante orgánico extremadamente persistente ; no se descompone fácilmente . Además, tiende a biomagnificarse a medida que pasa a lo largo de la cadena alimentaria . [3] La exposición a largo plazo ha demostrado ser tóxica para una amplia gama de animales, incluidos los humanos, mucho mayor que para los insectos objetivos originales. Las personas que ingirieron grandes cantidades de aldrín o dieldrín a propósito o accidentalmente han sufrido convulsiones (espasmos) y algunas murieron. Los trabajadores que estuvieron expuestos a cantidades menores de estos productos químicos, pero durante un período de tiempo más largo, tuvieron dolores de cabeza, mareos, irritabilidad, vómitos y movimiento muscular incontrolado. [4] Por esta razón, ahora está prohibido en la mayor parte del mundo.
Se ha relacionado con problemas de salud como la enfermedad de Parkinson , el cáncer de mama y daños en el sistema inmunológico, reproductivo y nervioso. También es un disruptor endocrino , que actúa como estrógeno y antiandrógeno , y puede afectar negativamente el desarrollo de los testículos en el feto . [5]
La dieldrina se puede formar a partir de la reacción de Diels-Alder de hexacloro-1,3-ciclopentadieno con norbornadieno seguida de epoxidación del producto de adición con un peroxiácido como el ácido peracético . [6]
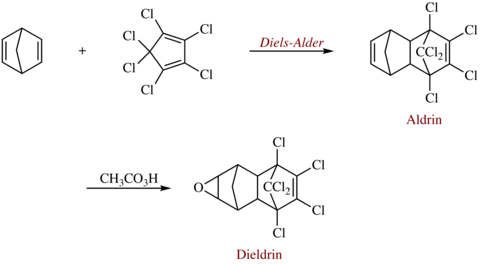
La dieldrina técnica contiene entre un 5 y un 15 % de policloroepoxioctahidrodimetanonaftalenos relacionados. [7] [8] El volumen de producción combinado estimado de aldrina y dieldrina en los EE. UU. alcanzó un máximo a mediados de la década de 1960 con alrededor de 20 millones de libras al año (2 millones de libras de dieldrina) y luego disminuyó. [3]
Los productos químicos dieldrín y aldrín se aplicaron ampliamente en áreas agrícolas en todo el mundo. Son pesticidas sintéticos de ciclodieno organoclorado que se utilizan para controlar plagas de insectos subterráneos como las larvas de la raíz de nargles, las larvas de grillos topo y los gorgojos, en la agricultura. [9] Ambos son tóxicos y bioacumulables . El aldrín se descompone en dieldrín en sistemas vivos, pero se sabe que el dieldrín resiste los procesos de descomposición química y bacteriana en el medio ambiente. Tanto el dieldrín como el aldrín han sido prohibidos (ver Legislación e historia a continuación).
La aldrina se utilizaba para controlar plagas del suelo (en concreto, termitas) en cultivos de maíz y patata. La dieldrina era un insecticida utilizado en frutas, suelo y semillas. Persiste en el suelo con una vida media de cinco años en latitudes templadas. Tanto la aldrina como la dieldrina pueden volatilizarse a partir de sedimentos y redistribuirse por corrientes de aire, contaminando zonas alejadas de sus fuentes. Se han medido en la fauna del Ártico, lo que sugiere un transporte a larga distancia desde las regiones agrícolas del sur. [10]
El metabolismo de la dieldrina se produce por varias vías. La hidratación del grupo epoxi por las epóxido hidrolasas conduce a la formación del trans -diol y del ácido dicarboxílico . El diol es el metabolito más importante producido por el conejo. [11] En la rata, la principal vía metabólica es la hidroxilación del grupo CH 2 por las monooxigenasas microsomales del hígado, lo que conduce a la producción de 9-hidroxidieldrina. [11] Hay enlaces de hidrógeno entre el OH y el grupo epoxi. Se excreta en las heces. [12] Es probable que este sea un ejemplo de recirculación enterohepática , ya que la bilis contiene el glucurónido . Este probablemente es escindido por la microflora intestinal.
Existe un metabolito interesante en la orina de rata, descrito por primera vez por Klein. [13] El grupo metileno de la dieldrina se une a un extremo del grupo ClC:CCl para formar una estructura de jaula. El otro extremo del ClC:CCl original se convierte en una cetona . El mismo metabolito se produce a partir del fotoisómero de la dieldrina, en el que se produce la misma estructura de jaula, pero el otro extremo del doble enlace clorado original forma un grupo CHCl.
Tanto el aldrín como el dieldrín han sido prohibidos en la mayoría de los países desarrollados, pero el aldrín todavía se utiliza como termiticida en Malasia, Tailandia, Venezuela y algunas partes de África. En Canadá, su venta se restringió a mediados de los años 1970, y el último uso registrado de los compuestos en Canadá se retiró en 1984. [14]
El Programa Internacional de Seguridad Química cita a la Organización Mundial de la Salud, que afirma que el dieldrín está prohibido para su uso en la agricultura en, entre otros, Brasil, Ecuador, Finlandia, la República Democrática Alemana, Singapur, Suecia, Yugoslavia y la URSS. La legislación de la Comunidad Europea prohíbe la comercialización de productos fitofarmacéuticos que contengan dieldrín. En Argentina, Canadá, Chile, la República Federal de Alemania, Hungría y los Estados Unidos, su uso está prohibido, con algunas excepciones. El uso del dieldrín está restringido en la India, Mauricio, Togo y el Reino Unido. Su uso en la industria está prohibido en Suiza y su fabricación y uso en Japón están bajo control gubernamental. En Finlandia, el único uso aceptado del dieldrín es como termiticida en una mezcla de pegamento para madera contrachapada exportada. La India exige registro y licencias para toda importación, fabricación, venta o almacenamiento.
El impulso contra los organoclorados y otras moléculas similares siguió creciendo a nivel internacional, lo que condujo a negociaciones que maduraron hasta convertirse en el Convenio de Estocolmo sobre Contaminantes Orgánicos Persistentes (COP). Los COP se definen como sustancias peligrosas y ambientalmente persistentes que pueden transportarse entre países a través de los océanos y la atmósfera de la Tierra.
La mayoría de los COP (incluido el dieldrín) se bioacumulan en los tejidos grasos de los seres humanos y otros animales. El Convenio de Estocolmo prohibió doce COP, apodados "los doce sucios". Entre ellos se encuentran el aldicarb , el toxafeno , el clordano y el heptacloro , el clordimeformo , el clorobencilato , el DBCP , el DDT, las " drinas " (aldrín, dieldrín y endrín), el EDB, el HCH y el lindano , el paraquat , el paratión y el metilparatión, el pentaclorofenol y el 2,4,5-T . Esta prohibición entró en vigor el 17 de mayo de 2004. Australia ratificó el Convenio sólo tres días después y se convirtió en parte del mismo en agosto de ese año. [15] La legislación australiana sobre la importación, el uso y la eliminación del dieldrín y otros organoclorados ha sido extensa y abarca principalmente los posibles impactos ambientales y sobre la salud de la población. [15]
El uso de organoclorados en Australia se redujo drásticamente entre mediados de los años 1970 y principios de los años 1980. Las primeras restricciones al uso de dieldrín y productos químicos relacionados en Australia se introdujeron en 1961-62, y se exigió un registro para su uso en animales destinados a la producción, como el ganado y los pollos. Esto coincidió con la creciente preocupación mundial por los efectos a largo plazo de los plaguicidas persistentes. La publicación de Primavera silenciosa (un relato de los efectos de los plaguicidas en el medio ambiente y la salud) por Rachel Carson en 1962 fue una fuerza impulsora clave para plantear esta preocupación. El proceso de eliminación gradual fue impulsado por prohibiciones gubernamentales y desregistros, a su vez promovidos por el cambio de percepción pública de que los alimentos que contenían residuos de estos productos químicos eran menos aceptables y posiblemente peligrosos para la salud. [15]
Durante todo este tiempo, los comités pertinentes, por ejemplo el Comité Técnico sobre Productos Químicos Agrícolas (TCAC), mantuvieron una presión constante para reducir el uso aprobado de organoclorados. En 1981, el uso de dieldrín en todo el mundo se limitaba a la caña de azúcar y el banano, y estos usos se eliminaron del registro en 1985. En 1987, se puso en marcha un sistema nacional de retirada de productos químicos y, en diciembre de ese año, el gobierno prohibió todas las importaciones de estos productos químicos a Australia sin la aprobación ministerial expresa. En 1994, la Autoridad Nacional de Registro de Productos Químicos Agrícolas y Veterinarios publicó un uso de organoclorados en el control de termitas, recomendando la eliminación gradual de los organoclorados utilizados en el control de termitas una vez que se desarrollaran alternativas viables. El mismo año, el Consejo de Agricultura y Gestión de Recursos de Australia y Nueva Zelanda decidió eliminar gradualmente los usos restantes de organoclorados para el 30 de junio de 1995, con la excepción del Territorio del Norte. En noviembre de 1997, se eliminó gradualmente el uso de todos los organoclorados excepto el mirex en Australia. Las existencias restantes de mirex se utilizarán únicamente como cebos contenidos para termitas en plantaciones de árboles jóvenes en el Territorio del Norte hasta que se agoten las existencias, lo que se espera que ocurra en un futuro próximo. [15]
El reconocimiento de los efectos negativos sobre la salud ha estimulado la aplicación de múltiples políticas legislativas en relación con el uso y la eliminación de plaguicidas organoclorados. Por ejemplo, la Política de Protección Ambiental (Marina) de 1994 entró en vigor en mayo de 1995 en Australia del Sur. Establece la concentración aceptable de sustancias tóxicas como la dieldrina en las aguas marinas y la manera en que se deben comprobar y evaluar esos niveles. [15]