Decapentapléjico (Dpp) es un morfógeno clave involucrado en el desarrollo de la mosca de la fruta Drosophila melanogaster y es el primer morfógeno secretado validado. [1] Se sabe que es necesario para el correcto modelado y desarrollo del embrión temprano de Drosophila y los quince discos imaginales , que son tejidos que se convertirán en extremidades y otros órganos y estructuras en la mosca adulta. También se ha sugerido que la Dpp desempeña un papel en la regulación del crecimiento y el tamaño de los tejidos. Las moscas con mutaciones en decapentapléjico no logran formar estas estructuras correctamente, de ahí el nombre ( decapenta- , quince, -pléjico , parálisis). Dpp es el homólogo de Drosophila de las proteínas morfogenéticas óseas de los vertebrados (BMP), que son miembros de la superfamilia TGF-β , una clase de proteínas que a menudo están asociadas con su propia vía de señalización específica. Los estudios de Dpp en Drosophila han permitido comprender mejor la función y la importancia de sus homólogos en vertebrados como los humanos.
Dpp es un morfógeno clásico, lo que significa que está presente en un gradiente de concentración espacial en los tejidos donde se encuentra, y su presencia como gradiente le da un significado funcional en cómo afecta el desarrollo. Los tejidos más estudiados en los que se encuentra Dpp son el embrión temprano y los discos del ala imaginal, que luego forman las alas de la mosca. Durante el desarrollo embrionario, la Dpp se expresa uniformemente en el lado dorsal del embrión, estableciendo un marcado gradiente de concentración. [2] En los discos imaginales, Dpp se expresa fuertemente en una franja estrecha de células en el medio del disco, donde el tejido marca el límite entre los lados anterior y posterior. Dpp se difunde desde esta franja hacia los bordes del tejido, formando un gradiente como se espera de un morfógeno. Sin embargo, aunque las células del dominio Dpp en el embrión no proliferan, las células del disco del ala imaginal proliferan intensamente, provocando el crecimiento del tejido. [1] Aunque se comprende bien la formación de gradientes en el embrión temprano, sigue siendo controvertido cómo se forma el gradiente del morfógeno Dpp en el disco imaginal del ala.
En la etapa temprana del blastodermo , la señalización de Dpp es uniforme y baja a lo largo del lado dorsal. Un perfil de señalización nítido emerge en la línea media dorsal del embrión durante la celularización, con niveles altos de Dpp que especifican la amnioserosa extraembrionaria y niveles bajos que especifican el ectodermo dorsal . [3] La señalización de Dpp también incorpora un mecanismo de retroalimentación positiva que promueve la futura unión de Dpp. [4] El gradiente de morfógenos en los embriones se establece mediante un mecanismo de transporte activo conocido. [5] La formación de gradientes depende de los inhibidores de BMP: gastrulación corta (Sog) y gastrulación retorcida (Tsg), y otras proteínas extracelulares como tolloide (Tld) y tornillo (Scw). [6] [7] [8] Sog se produce en la región ventral-lateral del embrión (perpendicular al gradiente de Dpp) y forma un gradiente inhibidor de BMP que evita que Dpp se una a su receptor. [9] Sog y Tsg forman un complejo con Dpp y se transportan activamente hacia la línea media dorsal (centro del embrión), siguiendo el gradiente de concentración de Sog. Tld, una metaloproteasa , libera Dpp del complejo mediando el procesamiento de Sog, activando la señalización de Dpp en la línea media. [10] Después de la gastrulación del embrión, el gradiente de Dpp induce la formación de mesodermo cardíaco y visceral . [11]
Dpp, al igual que sus homólogos vertebrados, es una molécula de señalización. En Drosophila, el receptor de Dpp está formado por dos proteínas, Thickveins (Tkv) y Punt. [12] Al igual que el propio Dpp, Tkv y Punt son muy similares a sus homólogos de otras especies. Cuando una célula recibe una señal de Dpp, los receptores son capaces de activar una proteína intracelular llamada madres contra Dpp (mad) mediante fosforilación. El descubrimiento inicial de mad en Drosophila allanó el camino para experimentos posteriores que identificaron el respondedor a la señalización de TGF-β en vertebrados, llamado SMAD . [13] Activated Mad es capaz de unirse al ADN y actuar como factor de transcripción para afectar la expresión de diferentes genes en respuesta a la señalización de Dpp. Los genes activados por la señalización de Dpp incluyen optomotor ciego (omb) y spalt, y la actividad de estos genes se utiliza a menudo como indicadores de la señalización de Dpp en experimentos. Otro gen con una interacción reguladora más complicada con Dpp es el brinker. Brinker es un factor de transcripción que reprime los objetivos de activación de Dpp, por lo que para activar estos genes, Dpp debe reprimir a Brinker y activar los otros objetivos. [14]
En el ala de la mosca, las mitades anterior y posterior del tejido están pobladas por diferentes tipos de células que expresan diferentes genes. Las células de la parte posterior, pero no de la anterior, expresan el factor de transcripción Engrailed (En). Uno de los genes activados por En es el hedgehog (hh), un factor de señalización. La señalización de Hedgehog indica a las células vecinas que expresen Dpp, pero En también reprime la expresión de Dpp. El resultado es que la Dpp sólo se produce en una estrecha franja de células inmediatamente adyacentes a la mitad posterior del tejido, pero no dentro de ella. [15] La Dpp producida en este borde anterior/posterior luego se difunde hacia los bordes del tejido, formando un gradiente de concentración espacial.
Al leer su posición a lo largo del gradiente de Dpp, las células del ala pueden determinar su ubicación en relación con el borde anterior/posterior y se comportan y desarrollan en consecuencia.
Es posible que en realidad no sea la difusión y el gradiente de Dpp lo que modela los tejidos, sino que las células que reciben la señal de Dpp instruyen a sus vecinas sobre lo que deben ser, y esas células a su vez envían señales a sus vecinas en una cascada a través del tejido. Se han realizado varios experimentos para refutar esta hipótesis y establecer que en realidad es el gradiente de las moléculas de Dpp reales el responsable del patrón.
Existen formas mutantes del receptor de Dpp Tkv que se comportan como si estuvieran recibiendo grandes cantidades de señal de Dpp incluso en ausencia de Dpp. Las células que contienen este receptor mutante se comportan como si estuvieran en un entorno de alta Dpp, como el área cercana a la franja de células que producen Dpp. Al generar pequeños parches de estas células en diferentes partes del tejido del ala, los investigadores pudieron distinguir cómo actúa la Dpp para modelar el tejido. Si las células que reciben una señal de Dpp instruyen a sus vecinas en una cascada, entonces deberían aparecer centros de patrones de tejido adicionales en los sitios de las células mutantes que parecen recibir una alta señalización de Dpp pero que no producen ninguna Dpp por sí mismas. Sin embargo, si la presencia física de Dpp es necesaria, entonces las células cercanas a los mutantes no deberían verse afectadas en absoluto. Los experimentos encontraron que el segundo caso es cierto, lo que indica que Dpp actúa como un morfógeno. [dieciséis]
La forma común de evaluar las diferencias en el patrón de tejido en el ala de la mosca es observar el patrón de venas en el ala. En las moscas donde la capacidad de la Dpp para difundirse a través del tejido está afectada, la posición de las venas cambia respecto a la de las moscas normales y el ala es generalmente más pequeña. [17]
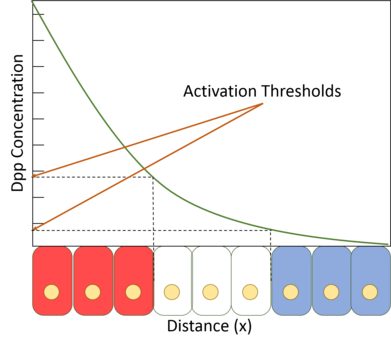
La Dpp también se ha propuesto como regulador del crecimiento y tamaño del tejido, un problema clásico en el desarrollo. Un problema común a los organismos con órganos multicelulares que deben crecer a partir de un tamaño inicial es cómo saber cuándo dejar de crecer una vez alcanzado el tamaño adecuado. Dado que Dpp está presente en un gradiente, es concebible que la pendiente del gradiente pueda ser la medida mediante la cual un tejido determina su tamaño. Si la cantidad de Dpp en la fuente es fija y la cantidad en el borde del tejido es cero, entonces la inclinación del gradiente disminuirá a medida que aumentan el tamaño del tejido y la distancia entre la fuente y el borde. Los experimentos en los que se induce un gradiente artificialmente pronunciado de Dpp en el tejido del ala dieron como resultado cantidades significativamente mayores de proliferación celular, lo que respalda la hipótesis de la inclinación. [18]
La forma del gradiente de Dpp está determinada por cuatro parámetros cinéticos del ligando que se ven afectados por parámetros biológicos: [19] [20]
Es importante señalar que un solo parámetro biológico puede afectar múltiples parámetros cinéticos. Por ejemplo, los niveles de receptores afectarán tanto al coeficiente de difusión como a las tasas de degradación. [21]
Sin embargo, el mecanismo por el cual se forma el gradiente Dpp sigue siendo controvertido y no se ha propuesto ni probado una explicación completa. Las cuatro categorías principales de teorías detrás de la formación del gradiente son la difusión libre, la difusión restringida, la transcitosis y el transporte asistido por citonemas .
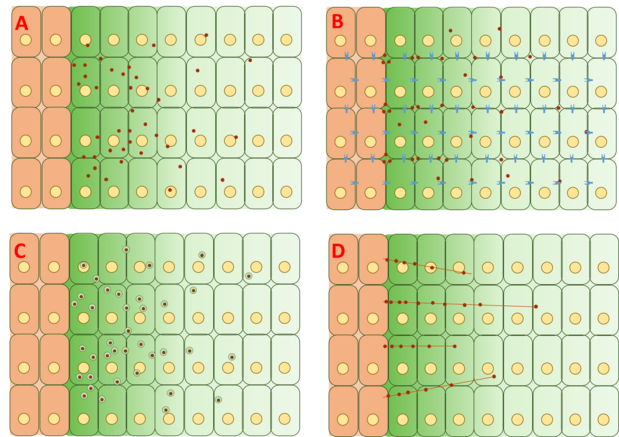
El modelo de difusión libre supone que la Dpp se difunde libremente a través de la matriz extracelular, degradándose mediante eventos de degradación mediados por receptores. Los ensayos FRAP han argumentado en contra de este modelo al señalar que la difusión de GFP-Dpp no coincide con la esperada de una molécula de tamaño similar. [20] Sin embargo, otros han argumentado que un paso lento que limite la velocidad más adelante en el proceso, como la inmovilización lenta y/o la degradación lenta del propio Dpp, podría explicar las diferencias observadas en la difusión. [22] Se han rastreado moléculas individuales de Dpp mediante espectroscopía de correlación de fluorescencia (FCS), lo que muestra que el 65% de las moléculas de Dpp se difunden rápidamente (de acuerdo con el modelo de difusión libre) y el 35% se difunden lentamente (de acuerdo con la Dpp unida a receptores o glipicanos ). .
El modelo de difusión restringida incluye los efectos de la geometría del empaquetamiento celular y las interacciones con la matriz extracelular a través de eventos de unión con receptores como Tkv y los proteoglicanos de sulfato de heparina dally y dally-like . [23] [24]
El modelo de transcitosis supone que la Dpp se transporta a través de rondas repetidas de endocitosis mediada por receptores intracelulares, con la gravedad del gradiente determinada por la clasificación endocitotica de la Dpp hacia el reciclaje a través de las células frente a la degradación. Este modelo se basó inicialmente en una observación inicial de que Dpp no podía acumularse en clones donde una proteína crítica llamada dinamina necesaria para la endocitosis había sido mutada al fenotipo shibire ( shi ). [25] Sin embargo, otros experimentos mostraron que Dpp podía acumularse sobre clones shi , desafiando el modelo de transcitosis. [26] Una revisión de la teoría detrás del modelo propone que la endocitosis no es esencial para el movimiento de Dpp, pero está involucrada en la señalización de Dpp. Dpp no logra moverse a través de las células con dally mutado y similar a dally , dos proteoglicanos de sulfato de heparina (HSPG) que se encuentran comúnmente en la matriz extracelular. Como resultado, estos resultados sugieren que Dpp se mueve a lo largo de la superficie celular a través de una difusión extracelular restringida que involucra dally y dally-like , pero el transporte de Dpp en sí no depende de la transcitosis. [27]
El modelo mediado por citonemas sugiere que la Dpp se transporta directamente a las células diana a través de filopodios basados en actina llamados citonemas que se extienden desde la superficie apical de las células que responden a la Dpp hasta las células fuente productoras de Dpp. [28] Estos citonemas se han observado, pero la dependencia del gradiente de Dpp de los citonemas no se ha demostrado definitivamente en los discos de las alas imaginales. Sin embargo, se sabe que la Dpp es necesaria y suficiente para extender y mantener los citonemas. Se llevaron a cabo experimentos que analizan la dinámica entre Dpp y citonemas en el primordio del saco aéreo, donde se descubrió que la señalización de Dpp tiene un vínculo funcional con los citonemas. Sin embargo, estos experimentos no se han replicado en discos de alas imaginales.
La Dpp también se encuentra en los moluscos, donde desempeña un papel clave en la formación de la concha al controlar la forma de la caracola. En los bivalvos, se expresa hasta que la protoconcha ha adquirido la forma requerida, momento a partir del cual cesa su expresión. [29] También se asocia con la formación de conchas en gasterópodos, [30] con una distribución asimétrica que puede estar asociada con su enrollamiento: el crecimiento de la concha parece estar inhibido donde se expresa Dpp . [31]