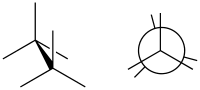

En química, una conformación eclipsada es una conformación en la que dos sustituyentes X e Y en los átomos adyacentes A, B están más cerca, lo que implica que el ángulo de torsión X – A – B – Y es 0 °. [1] Tal conformación puede existir en cualquier enlace químico simple de cadena abierta que conecte dos átomos hibridados sp 3 , y normalmente es un máximo de energía conformacional. Este máximo a menudo se explica por impedimento estérico , pero sus orígenes a veces residen en realidad en la hiperconjugación (como cuando la interacción eclipsante es de dos átomos de hidrógeno).
Para obtener una comprensión más profunda de las conformaciones eclipsadas en la química orgánica, primero es importante comprender cómo se organizan las moléculas orgánicas alrededor de los enlaces, así como también cómo se mueven y rotan.
En el ejemplo del etano, dos grupos metilo están conectados con un enlace sigma carbono-carbono , del mismo modo que se podrían conectar dos piezas de Lego a través de un solo “perno” y “tubo”. Con esta imagen en mente, si los grupos metilo giran alrededor del enlace, permanecerán conectados; sin embargo, la forma cambiará. Esto conduce a múltiples disposiciones tridimensionales posibles, conocidas como conformaciones, isómeros conformacionales (conformistas) o, a veces, isómeros rotacionales (rotámeros). [2]
Las conformaciones pueden describirse mediante ángulos diédricos , que se utilizan para determinar la ubicación de los átomos y su distancia entre sí y pueden visualizarse mediante proyecciones de Newman . Un ángulo diédrico puede indicar una orientación escalonada y eclipsada, pero se usa específicamente para determinar el ángulo entre dos átomos específicos en carbonos opuestos. Las diferentes conformaciones tienen energías desiguales, lo que crea una barrera energética a la rotación del enlace que se conoce como tensión torsional . En particular, las conformaciones eclipsadas tienden a tener energías elevadas debido a la repulsión de las nubes de electrones de los sustituyentes eclipsados.

Las energías relativas de diferentes conformaciones se pueden visualizar mediante gráficos. En el ejemplo del etano , este gráfico muestra que la rotación alrededor del enlace carbono-carbono no es completamente libre pero que existe una barrera energética. Se dice que la molécula de etano en la conformación eclipsada sufre tensión de torsión, y mediante una rotación alrededor del enlace carbono carbono hacia la conformación escalonada se libera alrededor de 12,5 kJ/mol de energía de torsión .

En el caso del butano y su cadena de cuatro carbonos, hay tres enlaces carbono-carbono disponibles para rotar. El siguiente ejemplo analiza el bono C2 y C3. A continuación se muestra el caballete y la representación de Newman del butano en una conformación eclipsada con los dos grupos CH 3 (C1 y C4) en un ángulo de 0 grados entre sí (izquierda).
Si el frente se gira 60° en el sentido de las agujas del reloj, la molécula de butano ahora tiene una conformación escalonada (derecha). Esta conformación se conoce más específicamente como conformación torpe del butano. Esto se debe a que los grupos metilo están escalonados, pero sólo a 60° entre sí. Esta conformación está más favorecida energéticamente que la conformación eclipsada, pero no es la conformación más favorable energéticamente. Otra rotación de 60° nos da una segunda conformación eclipsada donde ambos grupos metilo están alineados con átomos de hidrógeno. Una rotación más de 60° produce otra conformación escalonada denominada anticonformación . Esto ocurre cuando los grupos metilo están colocados opuestos (180°) uno del otro. Esta es la conformación energéticamente más favorable. [3]
Los mínimos se pueden ver en el gráfico a 60, 180 y 300 grados, mientras que los máximos se pueden ver a 0, 120, 240 y 360 grados. Los máximos representan las conformaciones eclipsadas debido al ángulo diédrico de cero grados. [4]
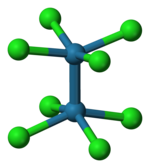
Según lo establecido por cristalografía de rayos X , el anión octaclorodimolibdato (II) ([Mo 2 Cl 8 ] 4- ) tiene una conformación eclipsada. Esta geometría estéricamente desfavorable se presenta como evidencia de un enlace cuádruple entre los centros de Mo. [5]
Experimentos como análisis de difracción de rayos X y electrones , resonancia magnética nuclear , espectroscopías de microondas y más han permitido a los investigadores determinar qué estructuras de cicloalcanos son las más estables en función de las diferentes conformaciones posibles. Otro método que demostró ser exitoso es la mecánica molecular , un método computacional que permite encontrar y analizar las energías de deformación totales de diferentes conformaciones. Se descubrió que las conformaciones más estables tenían energías más bajas según los valores de energía debido a las distancias y ángulos de enlace. [6]
En muchos casos, los isómeros de alcanos con cadenas ramificadas tienen puntos de ebullición más bajos que los que no están ramificados, lo que se ha demostrado mediante experimentación con isómeros de C 8 H 18 . Esto se debe a una combinación de fuerzas intermoleculares y tamaño que resulta de las cadenas ramificadas. Cuantas más ramas tenga un alcano, más extendida será su forma; mientras tanto, si está menos ramificado, tendrá más fuerzas de atracción intermoleculares que deberán romperse, lo que es la causa del aumento del punto de ebullición de los alcanos no ramificados. En otro caso, el 2,2,3,3-tetrametilbutano tiene una forma más parecida a un elipsoide, lo que le permite formar una red cristalina que eleva el punto de fusión de la molécula porque se necesitará más energía para pasar de un sólido a un estado liquido. [6]