Un enlace cuádruple es un tipo de enlace químico entre dos átomos que involucra ocho electrones . Este enlace es una extensión de los tipos más conocidos de enlaces covalentes : enlaces dobles y enlaces triples . [1] Los enlaces cuádruples estables son más comunes entre los metales de transición en el medio del bloque d , como el renio , el tungsteno , el tecnecio , el molibdeno y el cromo . Por lo general, los ligandos que soportan los enlaces cuádruples son donantes π , no aceptores π . Los enlaces cuádruples son raros en comparación con los enlaces dobles y triples , pero se han preparado cientos de compuestos con tales enlaces. [2]

El acetato de cromo (II) , Cr 2 ( μ -O 2 CCH 3 ) 4 (H 2 O) 2 , fue el primer compuesto químico que se sintetizó con un enlace cuádruple. Fue descrito en 1844 por E. Peligot , aunque su enlace distintivo no fue reconocido hasta más de un siglo después. [3]
El primer estudio cristalográfico de un compuesto con un enlace cuádruple fue proporcionado por químicos soviéticos para las sales de Re
2Cl2−
8. [4] Se observó la muy corta distancia Re-Re. Esta corta distancia (y el diamagnetismo de la sal) indicaban la unión Re-Re. Sin embargo, estos investigadores formularon erróneamente el anión como un derivado de Re(II), es decir, Re
2Cl4−
8.
Poco después, F. Albert Cotton y CB Harris informaron la estructura cristalina del octaclorodifenilhenato de potasio o K 2 [Re 2 Cl 8 ]·2H 2 O. [5] Este análisis estructural indicó que la caracterización anterior era errónea. Cotton y Harris formularon una justificación orbital molecular para el enlace que indicaba explícitamente un enlace cuádruple. [3] La longitud del enlace renio-renio en este compuesto es de solo 224 pm . En la teoría de orbitales moleculares , el enlace se describe como σ 2 π 4 δ 2 con un enlace sigma , dos enlaces pi y un enlace delta .
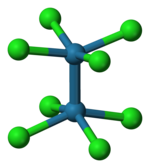

El ion [Re 2 Cl 8 ] 2− adopta una conformación eclipsada como se muestra a la izquierda. El orbital de enlace delta se forma entonces por la superposición de los orbitales d en cada átomo de renio, que son perpendiculares al eje Re–Re y se encuentran entre los enlaces Re–Cl. Los orbitales d dirigidos a lo largo de los enlaces Re–Cl se estabilizan por la interacción con los orbitales del ligando de cloro y no contribuyen a la unión Re–Re. [6] En contraste, el ion [Os 2 Cl 8 ] 2− con dos electrones más (σ 2 π 4 δ 2 δ* 2 ) tiene un triple enlace Os–Os y una geometría escalonada . [6]
Se han descrito muchos otros compuestos con enlaces cuádruples entre átomos de metales de transición, a menudo por Cotton y sus colaboradores. Isoelectrónico con el compuesto de dirhenio es la sal K 4 [Mo 2 Cl 8 ] ( octaclorodimolibdato de potasio ). [7] Un ejemplo de un compuesto de ditungsteno con un enlace cuádruple es el ditungsteno tetra(hpp) .
Los enlaces cuádruples entre átomos de elementos del grupo principal son desconocidos. Para la molécula de dicarbonato (C 2 ), como ejemplo, la teoría de orbitales moleculares muestra que hay dos conjuntos de electrones apareados en el sistema sigma (uno enlazante, uno antienlazante) y dos conjuntos de electrones apareados en un conjunto de orbitales degenerados de enlace π. Esto suma un orden de enlace de 2, lo que significa que existe un doble enlace entre los dos átomos de carbono . El diagrama de orbitales moleculares del carbono diatómico mostraría que hay dos enlaces pi y ningún enlace sigma. Un artículo de 2012 de S. Shaik et al. sugiere que existe un enlace cuádruple en el dicarbonato, [8] pero esto es discutido. [9]