En las reacciones de sustitución aromática electrófila , los grupos sustituyentes existentes en el anillo aromático influyen en la velocidad general de la reacción o tienen un efecto director sobre el isómero posicional de los productos que se forman.
Un grupo donador de electrones ( EDG ) o un grupo liberador de electrones ( ERG , Z en fórmulas estructurales) es un átomo o grupo funcional que dona parte de su densidad electrónica a un sistema π conjugado mediante resonancia (mesomería) o efectos inductivos (o inducción). llamados efectos +M o +I , respectivamente, lo que hace que el sistema π sea más nucleofílico . [1] [2] Como resultado de estos efectos electrónicos , es más probable que un anillo aromático al que esté unido dicho grupo participe en la reacción de sustitución electrófila . Por lo tanto, los EDG a menudo se conocen como grupos activadores , aunque los efectos estéricos pueden interferir con la reacción.
Un grupo aceptor de electrones (EWG) tendrá el efecto opuesto sobre la nucleofilicidad del anillo. El EWG elimina densidad electrónica de un sistema π, haciéndolo menos reactivo en este tipo de reacción, [2] [3] y por eso se le llama grupos desactivadores .
Los EDG y EWG también determinan las posiciones (en relación con ellos mismos) en el anillo aromático donde es más probable que se produzcan reacciones de sustitución. Los grupos donadores de electrones son generalmente directores orto/para para las sustituciones aromáticas electrófilas , mientras que los grupos aceptores de electrones (excepto los halógenos ) son generalmente metadirectores . Las selectividades observadas con EDG y EWG se describieron por primera vez en 1892 y se conocen como regla de Crum Brown-Gibson. [4]

Los grupos donadores de electrones generalmente se dividen en tres niveles de capacidad de activación (la categoría "extrema" puede verse como "fuerte"). Los grupos sustractores de electrones se asignan a agrupaciones similares. Los sustituyentes activadores favorecen la sustitución electrófila alrededor de las posiciones orto y para . Los grupos débilmente desactivadores dirigen a los electrófilos a atacar la molécula de benceno en las posiciones orto y para , mientras que los grupos fuertemente y moderadamente desactivantes dirigen los ataques a la posición meta . [5] Este no es un caso de favorecer la metaposición como grupos funcionales directores para y orto, sino más bien desfavorecer las posiciones orto y para más de lo que desfavorecen a la metaposición .
Los grupos activadores son en su mayoría donantes de resonancia (+M). Aunque muchos de estos grupos también se retiran inductivamente (–I), lo cual es un efecto desactivador, el efecto de resonancia (o mesomérico) es casi siempre más fuerte, con la excepción de Cl, Br e I.
En general, el efecto de resonancia de los elementos del tercer período y posteriores es relativamente débil. Esto se debe principalmente a la superposición orbital relativamente pobre del orbital 3p (o superior) del sustituyente con el orbital 2p del carbono.
Debido a un efecto de resonancia y un efecto inductivo más fuertes que los halógenos más pesados, el flúor es anómalo. El factor de velocidad parcial de sustitución aromática electrófila en el fluorobenceno suele ser mayor que uno en la posición para , lo que lo convierte en un grupo activador. [11] Por el contrario, está moderadamente desactivado en las posiciones orto y meta , debido a la proximidad de estas posiciones al sustituyente fluoro electronegativo.
Si bien todos los grupos desactivadores se retiran inductivamente (–I), la mayoría de ellos también se retiran mediante resonancia (–M). Los sustituyentes halógenos son una excepción: son donantes de resonancia (+M). Con excepción de los haluros, son grupos metadirectores .
Los haluros son grupos orto - paradirectores pero, a diferencia de la mayoría de los orto - paradirectores , los haluros desactivan ligeramente el areno. Este comportamiento inusual puede explicarse por dos propiedades:
Las propiedades inductivas y de resonancia compiten entre sí, pero el efecto de resonancia domina a la hora de dirigir los sitios de reactividad. Para la nitración, por ejemplo, el flúor se dirige fuertemente a la posición para porque la posición orto se desactiva inductivamente (86% para , 13% orto , 0,6% meta ). Por otro lado, el yodo se dirige a las posiciones orto y para de manera comparable (54% para y 45% orto , 1,3% meta ). [12]
Aunque la estructura electrónica completa de un areno sólo puede calcularse mediante la mecánica cuántica , los efectos directores de diferentes sustituyentes a menudo pueden adivinarse mediante el análisis de diagramas de resonancia.

Específicamente, cualquier carga formal negativa o positiva en contribuyentes de resonancia menores (los que están de acuerdo con la polarización natural pero que no necesariamente obedecen a la regla del octeto ) reflejan ubicaciones que tienen una densidad de carga mayor o menor en el orbital molecular de un enlace con mayor probabilidad de romperse . Un átomo de carbono con un coeficiente mayor será atacado preferentemente, debido a una superposición orbital más favorable con el electrófilo. [dieciséis]
La perturbación de un grupo conjugante aceptor o donador de electrones hace que la distribución de electrones π en un anillo de benceno se parezca (¡ muy ligeramente !) a un catión bencilo deficiente en electrones o a un anión bencilo excesivo en electrones, respectivamente. Esta última especie admite cálculos cuánticos manejables utilizando la teoría de Hückel : el catión retira densidad electrónica en las posiciones orto y para , favoreciendo el metaataque , mientras que el anión libera densidad electrónica en las mismas posiciones, activándolas para el ataque. [17] Este es precisamente el resultado que predeciría el dibujo de estructuras de resonancia.
Por ejemplo, la anilina tiene estructuras de resonancia con cargas negativas alrededor del sistema de anillos:

El ataque ocurre en las posiciones orto y para , porque las cargas negativas formales (parciales) en estas posiciones indican un exceso de electrones local. Por otro lado, las estructuras de resonancia de nitrobenceno tienen cargas positivas alrededor del sistema de anillos:
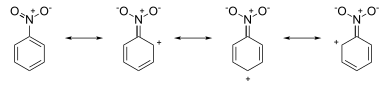
El ataque ocurre en la posición meta , ya que las cargas positivas formales (parciales) en las posiciones orto y para indican deficiencia de electrones en estas posiciones.
Otro argumento común, que hace predicciones idénticas, considera la estabilización o desestabilización por sustituyentes de los intermedios de Wheland resultantes del ataque electrofílico en las posiciones orto / para o meta . El postulado de Hammond dicta entonces que las energías relativas del estado de transición reflejarán las diferencias en las energías del estado fundamental de los intermedios de Wheland. [14] [18]
Debido a la carga positiva total o parcial del elemento directamente unido al anillo de cada uno de estos grupos, todos tienen un efecto inductivo de extracción de electrones de moderado a fuerte (conocido como efecto -I). También exhiben efectos de resonancia atractora de electrones (conocido como efecto -M):

Por lo tanto, estos grupos hacen que el anillo aromático sea muy pobre en electrones (δ+) en relación con el benceno y, por lo tanto, desactivan fuertemente el anillo (es decir, las reacciones proceden mucho más lentamente en los anillos que llevan estos grupos en comparación con las reacciones en el benceno).
Debido a la diferencia de electronegatividad entre el carbono y el oxígeno/nitrógeno, habrá un ligero efecto de extracción de electrones a través del efecto inductivo (conocido como efecto –I). Sin embargo, el otro efecto llamado resonancia añade densidad electrónica al anillo (conocido como efecto +M) y domina sobre el efecto inductivo. Por lo tanto, el resultado es que son EDG y orto / para directores.
El fenol es un director orto/para, pero en presencia de base, la reacción es más rápida. Se debe a la mayor reactividad del anión fenolato . El oxígeno negativo fue "obligado" a dar densidad electrónica a los carbonos (debido a que tiene carga negativa, tiene un efecto +I adicional). Incluso en frío y con electrófilos neutros (y relativamente débiles), la reacción sigue produciéndose rápidamente.

Los grupos alquilo son grupos donadores de electrones. El carbono que contiene tiene hibridación sp 3 y es menos electronegativo que los que tienen hibridación sp 2 . Se superponen en los enlaces carbono-hidrógeno (o enlaces carbono-carbono en compuestos como el terc -butilbenceno) con el orbital p del anillo. Por lo tanto, son más reactivos que el benceno y son directores orto / para .
Inductivamente, el ion carboxilato cargado negativamente repele moderadamente los electrones del enlace que lo une al anillo. Por tanto, existe un débil efecto +I donador de electrones. Se produce un efecto -M casi nulo, ya que la capacidad de resonancia aceptora de electrones del grupo carbonilo se elimina eficazmente mediante la deslocalización de la carga negativa del anión en el oxígeno. Así, en general, el grupo carboxilato (a diferencia del grupo carboxilo ) tiene una influencia activadora. [10]

Estos grupos tienen un fuerte efecto inductivo aceptor de electrones (-I), ya sea debido a su carga positiva o debido a la poderosa electronegatividad de los halógenos. No hay efecto de resonancia porque no hay orbitales ni pares de electrones que puedan superponerse a los del anillo. El efecto inductivo actúa así para el anión carboxilato pero en la dirección opuesta (es decir, produce pequeñas cargas positivas en las posiciones orto y para pero no en la posición meta y desestabiliza el intermedio de Wheland ). Por lo tanto, estos grupos son desactivadores y metadirectores . :

El flúor es una especie de anomalía en esta circunstancia. Arriba, se describe como un grupo aceptor de electrones débil, pero esto es sólo parcialmente cierto. Es cierto que el flúor tiene un efecto -I, que da como resultado la extracción de electrones de forma inductiva. Sin embargo, otro efecto que influye es el efecto +M, que vuelve a agregar densidad de electrones al anillo de benceno (teniendo así el efecto opuesto al efecto -I, pero mediante un mecanismo diferente). Esto se llama efecto mesomérico (por lo tanto +M) y el resultado para el flúor es que el efecto +M anula aproximadamente el efecto -I. El efecto de esto para el fluorobenceno en la posición para es una reactividad comparable (o incluso superior) a la del benceno . Debido a que los efectos inductivos dependen en gran medida de la proximidad, las posiciones meta y orto del fluorobenceno son considerablemente menos reactivas que el benceno. Por tanto, la sustitución aromática electrófila del fluorobenceno es fuertemente paraselectiva .
Este efecto -I y +M es cierto para todos los haluros: existe cierto carácter de extracción y donación de electrones en cada uno. Para comprender por qué ocurren los cambios de reactividad, debemos considerar las superposiciones orbitales que ocurren en cada uno. Los orbitales de valencia del flúor son los orbitales 2p, que son los mismos para el carbono; por lo tanto, tendrán una energía muy cercana y la superposición de orbitales será favorable. El cloro tiene orbitales de valencia 3p, por lo que las energías orbitales estarán más separadas y la geometría será menos favorable, lo que conducirá a una menor donación para estabilizar el intermedio carbocatiónico, por lo que el clorobenceno es menos reactivo que el fluorobenceno . Sin embargo, el bromobenceno y el yodobenceno son aproximadamente igual o un poco más reactivos que el clorobenceno, porque aunque la donación de resonancia es aún peor, el efecto inductivo también se ve debilitado debido a sus electronegatividades más bajas. Por lo tanto, el orden general de reactividad tiene forma de U, con un mínimo en clorobenceno/bromobenceno (tasas de nitración relativas en comparación con el benceno = 1 entre paréntesis): PhF (0,18) > PhCl (0,064) ~ PhBr (0,060) < PhI (0,12) . [12] Pero aún así, todos los halobencenos reaccionan más lentamente que el propio benceno.
Observe que el yodobenceno es aún menos reactivo que el fluorobenceno porque la polarizabilidad también influye. Esto también puede explicar por qué el fósforo en los fosfanos no puede donar densidad electrónica al carbono mediante inducción (es decir, efecto +I) aunque es menos electronegativo que el carbono (2,19 frente a 2,55, consulte la lista de electronegatividad ) y por qué el ácido yodhídrico ( pKa = -10) siendo mucho más ácido que el ácido fluorhídrico (pKa = 3). (Eso es 10 13 veces más ácido que el ácido fluorhídrico)
Debido al par de electrones solitarios, hay grupos halógenos disponibles para donar electrones. De ahí que sean directores orto / para .
Debido a la diferencia de electronegatividad entre el carbono y el nitrógeno, el grupo nitroso tiene un efecto -I relativamente fuerte, pero no tan fuerte como el grupo nitro. (Los átomos de nitrógeno cargados positivamente en cationes de alquilamonio y en grupos nitro tienen un efecto -I mucho más fuerte)
El grupo nitroso tiene un efecto +M y -M, pero el efecto -M es más favorable.
El nitrógeno tiene un par de electrones solitarios. Sin embargo, el par solitario de su forma monómera no es favorable para la donación mediante resonancia. Sólo la forma dímera está disponible para el efecto +M. Sin embargo, la forma dímera es menos estable en una solución. Por tanto, el grupo nitroso está menos disponible para donar electrones.
Por el contrario, retirar densidad de electrones es más favorable: (ver imagen de la derecha).
.jpg/440px-Nitrosobenzene_resonance_(by_pi_bonds).jpg)
Como resultado, el grupo nitroso es un desactivador. Sin embargo, tiene disponible para donar densidad electrónica al anillo de benceno durante el intermedio de Wheland , por lo que sigue siendo un director orto / para .
Hay 2 posiciones orto , 2 posiciones meta y 1 posición para en el benceno cuando se le adjunta un grupo. Cuando un grupo es un director orto/para con posiciones orto y para reaccionando con el mismo factor de tasa parcial, esperaríamos el doble de producto orto que para producto debido a este efecto estadístico. Sin embargo, los factores de tasa parcial en las posiciones orto y para generalmente no son iguales. En el caso de un sustituyente flúor, por ejemplo, el factor de velocidad parcial orto es mucho menor que el para , debido a un efecto de retirada inductivo más fuerte en la posición orto . Aparte de estos efectos, a menudo también hay un efecto estérico , debido al aumento del impedimento estérico en la posición orto pero no en la posición para , lo que lleva a una mayor cantidad del producto para .
El efecto se ilustra para sustituciones aromáticas electrófilas con sustituyentes alquilo de diferente demanda estérica para la nitración aromática electrófila. [19]
El grupo metilo en el tolueno es pequeño y hará que el producto orto sea el producto principal. Por otro lado, el grupo t -butilo es muy voluminoso (hay 3 grupos metilo unidos a un solo carbono) y encabezará el producto para como el principal. Incluso con tolueno, el producto no es 2:1 sino que tiene un producto ligeramente menos orto .
Cuando ya hay dos sustituyentes presentes en el anillo, la nueva ubicación del tercer sustituyente es relativamente predecible. Si los sustituyentes existentes se refuerzan o la molécula es muy simétrica, puede que no haya ambigüedad. De lo contrario: [20]




{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) Mantenimiento de CS1: varios nombres: lista de autores ( enlace ){{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) Mantenimiento de CS1: varios nombres: lista de autores ( enlace ){{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )