
Un diol es un compuesto químico que contiene dos grupos hidroxilo ( grupos −OH ). [1] Un diol alifático también puede llamarse glicol . [2] Este emparejamiento de grupos funcionales es generalizado y se han identificado muchas subcategorías. Se utilizan como grupos protectores de grupos carbonilo , lo que los hace esenciales en la síntesis de la química orgánica. [3]
El diol industrial más común es el etilenglicol . Entre los dioles en los que los grupos funcionales hidroxilo están más ampliamente separados se incluyen el 1,4-butanodiol HO−(CH 2 ) 4 −OH y el propilen-1,3-diol , o beta propilenglicol, HO−CH 2 −CH 2 −CH 2 −OH .
Un diol geminal tiene dos grupos hidroxilo unidos al mismo átomo. Estas especies surgen por hidratación de los compuestos carbonílicos. La hidratación suele ser desfavorable, pero una excepción notable es el formaldehído que, en agua, existe en equilibrio con el metanodiol H 2 C(OH) 2 . [4] Otro ejemplo es (F 3 C) 2 C(OH) 2 , la forma hidratada de la hexafluoroacetona . Muchos gem-dioles experimentan una condensación adicional para dar derivados diméricos y oligoméricos. Esta reacción se aplica al glioxal y a los aldehídos relacionados .
En un diol vecinal, los dos grupos hidroxilo ocupan posiciones vecinales , es decir, están unidos a átomos adyacentes. Estos compuestos se denominan glicoles [5] (aunque el término se puede utilizar de forma más amplia). Los ejemplos incluyen etano-1,2-diol o etilenglicol HO−(CH 2 ) 2 −OH, un ingrediente común de los productos anticongelantes . Otro ejemplo es el propano-1,2-diol , o alfa propilenglicol, HO−CH 2 −CH(OH)−CH 3 , utilizado en la industria alimentaria y farmacéutica, así como un producto anticongelante relativamente no tóxico.
A escala comercial, la principal vía para obtener dioles vecinales es la hidrólisis de epóxidos . Los epóxidos se preparan mediante epoxidación del alqueno. Un ejemplo es la síntesis de trans-ciclohexanodiol [6] o mediante microrreactor : [7]
Para la investigación académica y las áreas farmacéuticas, los dioles vecinales a menudo se producen a partir de la oxidación de alquenos , generalmente con permanganato de potasio ácido diluido o tetróxido de osmio. [8] El tetróxido de osmio se puede utilizar de manera similar para oxidar alquenos a dioles vecinales. La reacción química llamada dihidroxilación asimétrica de Sharpless se puede utilizar para producir dioles quirales a partir de alquenos utilizando un reactivo osmato y un catalizador quiral . Otro método es la cis-hidroxilación de Woodward (cis diol) y la reacción relacionada de Prévost (anti diol), que utilizan yodo y la sal de plata de un ácido carboxílico.
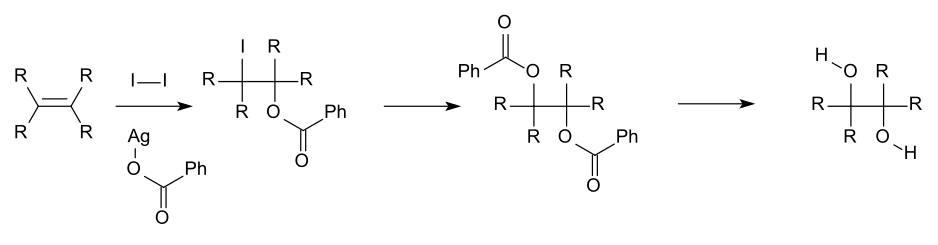
Otras rutas para obtener vic-dioles son la hidrogenación de aciloínas [9] y la reacción de acoplamiento de pinacol .
Los 1,3-dioles se preparan a menudo industrialmente mediante condensación aldólica de cetonas con formaldehído . Se pueden utilizar muchos materiales de partida diferentes para producir sin- o anti-1,3-dioles. [10] El carbonilo resultante se reduce mediante la reacción de Cannizzaro o mediante hidrogenación catalítica :
De esta manera se preparan propano-1,3-dioles 2,2-disustituidos. Entre los ejemplos se incluyen 2-metil-2-propil-1,3-propanodiol y neopentilglicol .
Los 1,3-dioles se pueden preparar mediante la hidratación de cetonas y aldehídos α,β-insaturados. El cetoalcohol resultante se hidrogena. Otra vía implica la hidroformilación de epóxidos seguida de la hidrogenación del aldehído. Este método se ha utilizado para el 1,3-propanodiol a partir de óxido de etileno .
Las rutas más especializadas para los 1,3-dioles implican la reacción entre un alqueno y formaldehído , la reacción de Prins . Los 1,3-dioles se pueden producir de forma diastereoselectiva a partir de las β- hidroxicetonas correspondientes utilizando los protocolos de reducción de Evans-Saksena , Narasaka-Prasad o Evans-Tishchenko .
Los 1,3-dioles se describen como sin o anti según la estereoquímica relativa de los átomos de carbono que contienen los grupos funcionales hidroxilo. La zincoforina es un producto natural que contiene 1,3-dioles sin y anti .
Los dioles en los que los grupos hidroxilo están separados por varios centros de carbono se preparan generalmente por hidrogenación de diésteres de los ácidos dicarboxílicos correspondientes :
El 1,4-butanodiol , el 1,5-pentanodiol , el 1,6-hexanodiol y el 1,10-decanodiol son precursores importantes de los poliuretanos . [11]
Desde la perspectiva industrial, las reacciones dominantes de los dioles son en la producción de poliuretanos y resinas alquídicas . [11]
Los dioles reaccionan como alcoholes , por esterificación y formación de éter . [12]
Los dioles como el etilenglicol se utilizan como comonómeros en reacciones de polimerización que forman polímeros que incluyen algunos poliésteres y poliuretanos . [12] Se requiere un monómero diferente con dos grupos funcionales idénticos, como un dicloruro de dioilo o ácido dioico, para continuar el proceso de polimerización a través de procesos de esterificación repetidos.
Un diol se puede convertir en un éter cíclico utilizando un catalizador ácido, lo que se conoce como ciclización del diol. En primer lugar, implica la protonación del grupo hidroxilo. Luego, seguida de una sustitución nucleofílica intramolecular, el segundo grupo hidroxilo ataca al carbono deficiente en electrones. Siempre que haya suficientes átomos de carbono para que la tensión angular no sea demasiado grande, se puede formar un éter cíclico.

Los 1,2-dioles y 1,3-dioles se pueden proteger utilizando un grupo protector. [13] Los grupos protectores se utilizan para que el grupo funcional no reaccione en reacciones futuras. Los grupos bencilideno se utilizan para proteger los 1,3-dioles. [13] Son extremadamente útiles en bioquímica, como se muestra a continuación, de un derivado de carbohidrato que se está protegiendo.

Los dioles también se pueden utilizar para proteger grupos carbonilo. [14] Se utilizan comúnmente y son bastante eficientes para sintetizar acetales cíclicos. Estos protegen a los grupos carbonilo de reaccionar con cualquier síntesis posterior hasta que sea necesario eliminarlos. La reacción a continuación muestra un diol que se utiliza para proteger un carbonilo utilizando tetracloruro de circonio. [15]
Los dioles también pueden convertirse en lactonas empleando la reacción de oxidación de Fétizon .
En la escisión del glicol , el enlace C−C en un diol vecinal se escinde con la formación de grupos funcionales cetona o aldehído. Véase Oxidación de diol .
En general, los dioles geminales orgánicos se deshidratan fácilmente para formar un grupo carbonilo .