El principio de Curtin-Hammett es un principio de cinética química propuesto por David Yarrow Curtin y Louis Plack Hammett . Afirma que, para una reacción que tiene un par de intermediarios reactivos o reactantes que se interconvierten rápidamente (como suele ser el caso de los isómeros conformacionales ), cada uno de los cuales se convierte irreversiblemente en un producto diferente, la proporción de productos dependerá tanto de la diferencia de energía entre los dos confórmeros como de las barreras de energía de cada uno de los isómeros que se equilibran rápidamente a sus respectivos productos. Dicho de otra manera, la distribución del producto refleja la diferencia de energía entre los dos estados de transición limitantes de la velocidad. Como resultado, la distribución del producto no reflejará necesariamente la distribución de equilibrio de los dos intermediarios. [1] [2] El principio de Curtin-Hammett se ha invocado para explicar la selectividad en una variedad de reacciones estereo y regioselectivas. La relación entre las constantes de velocidad (aparentes) y la constante de equilibrio se conoce como la ecuación de Winstein -Holness.
El principio de Curtin-Hammett se aplica a sistemas en los que se forman diferentes productos a partir de dos sustratos en equilibrio entre sí. Los reactivos que se interconvierten rápidamente pueden tener cualquier relación entre sí ( estereoisómeros , isómeros constitucionales , isómeros conformacionales, etc.). La formación de productos debe ser irreversible y los diferentes productos deben ser incapaces de interconvertirse. [3]
Por ejemplo, dadas las especies A y B que se equilibran rápidamente mientras A se convierte irreversiblemente en C y B se convierte irreversiblemente en D :
K es la constante de equilibrio entre A y B , y k 1 y k 2 son las constantes de velocidad para la formación de C y D , respectivamente. Cuando la velocidad de interconversión entre A y B es mucho más rápida que k 1 o k 2 , entonces el principio de Curtin-Hammett nos dice que la relación de productos C : D no es igual a la relación de equilibrio de reactivos A : B , sino que está determinada por las energías relativas de los estados de transición (es decir, la diferencia en las energías absolutas de los estados de transición). Si los reactivos A y B tuvieran energías idénticas, la relación de productos dependería solo de las barreras de activación de las reacciones que conducen a cada producto respectivo. Sin embargo, en un escenario del mundo real, es probable que los dos reactivos tengan niveles de energía algo diferentes, aunque la barrera para su interconversión debe ser baja para que se aplique el escenario de Curtin-Hammett. En este caso, la distribución de productos depende tanto de la relación de equilibrio de A a B como de las barreras de activación relativas que van a los productos correspondientes C y D. Ambos factores se tienen en cuenta por la diferencia de energías de los estados de transición (ΔΔ G ‡ en la figura siguiente).
El perfil de energía libre de coordenadas de reacción de una reacción típica bajo control de Curtin-Hammett está representado por la siguiente figura:
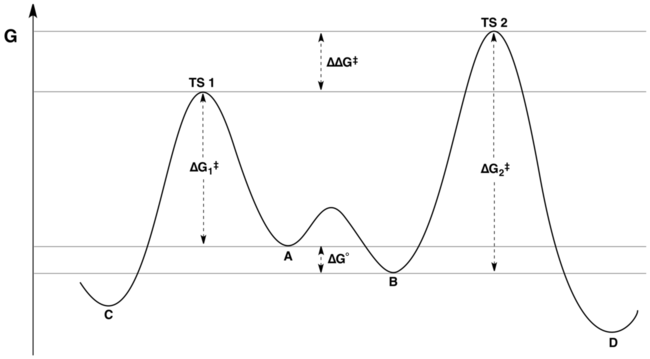
La proporción de productos solo depende del valor etiquetado ΔΔ G ‡ en la figura: C será el producto principal, porque la energía de TS1 es menor que la energía de TS2 . Una afirmación común pero falsa es que la distribución de productos no refleja de ninguna manera las energías libres relativas de los sustratos A y B ; de hecho, refleja las energías libres relativas de los sustratos y las energías de activación relativas. [3] [4] Este malentendido puede deberse a no apreciar la distinción entre "la diferencia de energías de activación" y "la diferencia en las energías del estado de transición". Aunque estas cantidades pueden parecer sinónimas a primera vista, la última tiene en cuenta la constante de equilibrio para la interconversión de A y B , mientras que la primera no.
Matemáticamente, la relación de productos se puede expresar como una función de K , k 1 y k 2 o en términos de las energías correspondientes Δ G °, Δ G 1 ‡ y Δ G 2 ‡ . Al combinar términos, la relación de productos se puede reescribir en términos de la cantidad ΔΔ G ‡ solamente, donde ΔΔ G ‡ = (Δ G 2 ‡ – Δ G 1 ‡ ) + Δ G °. La inspección del diagrama de energía (mostrado arriba) hace evidente que ΔΔ G ‡ es precisamente la diferencia en las energías del estado de transición.
Una reacción genérica según Curtin-Hammett se puede describir mediante los siguientes parámetros:
Para que el equilibrio rápido sea una buena suposición, la tasa de conversión del menos estable de A o B al producto C o D debe ser al menos 10 veces más lenta que la tasa de equilibrio entre A y B. [5 ]
La velocidad de formación del compuesto C a partir de A se da como
y la de D de B como
con la segunda igualdad aproximada que se desprende del supuesto de equilibrio rápido. Bajo este supuesto, la relación de los productos es entonces
En otras palabras, debido a que la equilibración es rápida en comparación con la formación del producto, durante toda la reacción, también permanece aproximadamente constante a lo largo de la reacción. A su vez, la integración con respecto al tiempo implica que también adquiere un valor aproximadamente constante a lo largo de la reacción, es decir , .
En términos de las energías del estado fundamental y del estado de transición, la relación del producto se puede escribir como:
Es importante destacar que la inspección del diagrama de energía anterior nos permite identificar
con la diferencia de energía de los estados de transición, dándonos una ecuación simplificada que captura la esencia del principio de Curtin-Hammett:
Así, aunque la relación de productos depende de la constante de equilibrio entre A y B y de la diferencia de energía entre las barreras de A a C y de B a D , ambos factores se tienen en cuenta automáticamente por la diferencia de energía de los estados de transición que conducen a los productos, ΔΔ G ‡ .
El principio de Curtin-Hammett puede explicar tres clases principales de reacciones: o bien el confórmero más o menos estable puede reaccionar más rápidamente, o bien ambos pueden reaccionar a la misma velocidad.
Una categoría de reacciones bajo el control de Curtin-Hammett incluye las transformaciones en las que el confórmero más estable reacciona más rápidamente. Esto ocurre cuando el estado de transición del intermediario principal a su producto respectivo tiene menor energía que el estado de transición del intermediario menor al otro producto posible. El producto principal se deriva entonces del confórmero principal y la distribución del producto no refleja la distribución del confórmero de equilibrio.
Un ejemplo de un escenario de Curtin-Hammett en el que el isómero conformacional más estable reacciona más rápidamente se observa durante la oxidación de piperidinas . En el caso de la N-metilpiperidina, la inversión en el nitrógeno entre los confórmeros diastereoméricos es mucho más rápida que la velocidad de oxidación de la amina. [6] La conformación que coloca al grupo metilo en la posición ecuatorial es 3,16 kcal/mol más estable que la conformación axial. [7] La relación de productos de 95:5 indica que el confórmero más estable conduce al producto principal. [8]

Una segunda categoría de reacciones bajo el control de Curtin-Hammett incluye aquellas en las que el confórmero menos estable reacciona más rápidamente. En este caso, a pesar de una preferencia energética por las especies menos reactivas, el producto principal se deriva de las especies de mayor energía. Una implicación importante es que el producto de una reacción puede derivarse de un confórmero que se encuentra en una concentración suficientemente baja como para ser inobservable en el estado fundamental. [3]
La alquilación de tropanos con yoduro de metilo es un ejemplo clásico de un escenario de Curtin-Hammett en el que un producto principal puede surgir de una conformación menos estable. [3] Aquí, el confórmero menos estable reacciona a través de un estado de transición más estable para formar el producto principal. [9] Por lo tanto, la distribución conformacional del estado fundamental no refleja la distribución del producto.

Es hipotéticamente posible que dos confórmeros diferentes en equilibrio pudieran reaccionar a través de estados de transición que son iguales en energía. En este caso, la selectividad del producto dependería únicamente de la distribución de los confórmeros del estado fundamental. En este caso, ambos confórmeros reaccionarían a la misma velocidad.
Ernest L. Eliel ha propuesto que la reacción hipotética del yoduro de ciclohexilo con yoduro radiomarcado daría como resultado un estado de transición completamente simétrico. [10] Debido a que tanto los confórmeros ecuatoriales como los sustituidos axialmente reaccionarían a través del mismo estado de transición, ΔΔG ‡ sería igual a cero. Por el principio de Curtin-Hammett, la distribución de productos debería ser entonces 50% sustituidos axialmente y 50% sustituidos ecuatorialmente. Sin embargo, el equilibrio de los productos impide la observación de este fenómeno. [3]

Cuando las energías del estado fundamental son diferentes pero las energías del estado de transición son similares, la selectividad se degradará en el estado de transición y se puede observar una selectividad general deficiente. Por ejemplo, se observa una alta selectividad para un confórmero del estado fundamental en la siguiente reacción de metilación radical . [11]

El confórmero en el que se minimiza la tensión A(1,3) se encuentra en un mínimo de energía, lo que da una selectividad de 99:1 en el estado fundamental. Sin embargo, las energías del estado de transición dependen tanto de la presencia de la tensión A(1,3) como del impedimento estérico asociado con el radical metilo entrante. En este caso, estos dos factores están en oposición, y la diferencia en las energías del estado de transición es pequeña en comparación con la diferencia en las energías del estado fundamental. Como resultado, se observa una selectividad general deficiente en la reacción.
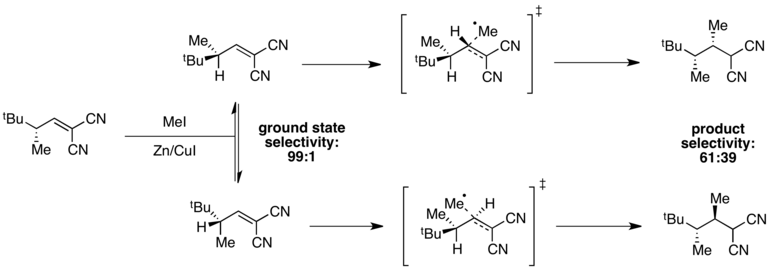
El principio de Curtin-Hammett se utiliza para explicar las razones de selectividad de algunas reacciones estereoselectivas .
El principio de Curtin-Hammett puede explicar la dinámica observada en las transformaciones que emplean resolución cinética dinámica , como la hidrogenación asimétrica de Noyori [12] y la litiación enantioselectiva. [13]
El rápido equilibrio entre los confórmeros enantioméricos y la hidrogenación irreversible colocan la reacción bajo el control de Curtin-Hammett. El uso de un catalizador quiral da como resultado un estado de transición de mayor y menor energía para la hidrogenación de los dos enantiómeros. La transformación ocurre a través del estado de transición de menor energía para formar el producto como un solo enantiómero. [14] De acuerdo con el principio de Curtin-Hammett, la proporción de productos depende de la barrera energética absoluta del paso irreversible de la reacción y no refleja la distribución de equilibrio de los confórmeros del sustrato. El perfil de energía libre relativa de un ejemplo de la hidrogenación asimétrica de Noyori se muestra a continuación:

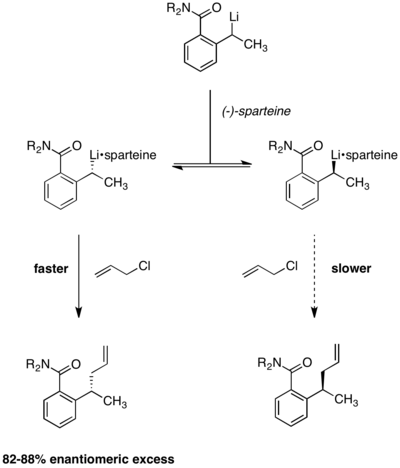
La resolución cinética dinámica en condiciones de Curtin-Hammett también se ha aplicado a reacciones de litiación enantioselectiva . En la reacción que se muestra a continuación, se observó que las enantioselectividades del producto eran independientes de la quiralidad del material de partida. El uso de (−)-esparteína es esencial para la enantioselectividad, ya que en su ausencia se forma un producto racémico . [13] El equilibrio entre los dos complejos de alquil-litio se demostró mediante la observación de que la enantioselectividad se mantuvo constante a lo largo de la reacción. Si los dos complejos reactivos no se interconvirtieran rápidamente, la enantioselectividad se erosionaría con el tiempo a medida que se agotara el confórmero de reacción más rápida.
Se ha invocado el principio de Curtin-Hammett para explicar la regioselectividad en la acilación de 1,2-dioles. Normalmente, el sitio menos impedido de un 1,2-diol asimétrico experimentaría una esterificación más rápida debido a un impedimento estérico reducido entre el diol y el reactivo acilante. El desarrollo de una esterificación selectiva del grupo hidroxilo más sustituido es una transformación útil en la química orgánica sintética, particularmente en la síntesis de carbohidratos y otros compuestos polihidroxilados. [15] Los acetales de estannileno se han utilizado para lograr de manera eficiente esta transformación. [16]

El diol asimétrico se trata primero con un reactivo de estaño para producir el acetal de dibutilestannileno. A continuación, este compuesto se trata con un equivalente de cloruro de acilo para producir el monoéster de estannilo. Hay dos isómeros del éster de estannilo accesibles y pueden experimentar una rápida interconversión a través de un intermedio tetraédrico. Inicialmente, predomina el isómero menos estable, ya que se forma más rápidamente a partir del acetal de estannilo. Sin embargo, al permitir que los dos isómeros se equilibren, se produce un exceso del alcoxi estannano primario más estable en solución. Luego, la reacción se extingue de manera irreversible y el alcoxi estannano primario menos impedido reacciona más rápidamente. Esto da como resultado la producción selectiva del monoéster más sustituido. Este es un escenario de Curtin-Hammett en el que el isómero más estable también reacciona más rápidamente.

La epoxidación de alquenos asimétricos también se ha estudiado como un ejemplo de cinética de Curtin-Hammett. En un estudio computacional de la epoxidación diastereoselectiva de alcoholes alílicos quirales por complejos de peroxi de titanio, la diferencia calculada en las energías del estado de transición entre los dos confórmeros fue de 1,43 kcal/mol. [17] Experimentalmente, la relación de productos observada fue de 91:9 a favor del producto derivado del estado de transición de menor energía. Esta relación de productos es consistente con la diferencia calculada en las energías del estado de transición. Este es un ejemplo en el que el confórmero favorecido en el estado fundamental, que experimenta una tensión A(1,3) reducida, reacciona a través de un estado de transición de menor energía para formar el producto principal.

Se ha invocado el principio de Curtin-Hammett para explicar la selectividad en diversas vías sintéticas. Un ejemplo se observa en la ruta hacia el antibiótico antitumoral AT2433-A1, en el que se produce una ciclización de tipo Mannich con excelente regioselectividad. Los estudios demuestran que el paso de ciclización es irreversible en el disolvente utilizado para llevar a cabo la reacción, lo que sugiere que la cinética de Curtin-Hammett puede explicar la selectividad del producto. [18]

Se invocó un escenario de Curtin-Hammett para explicar la selectividad en las síntesis de kapakahines B y F, dos péptidos cíclicos aislados de esponjas marinas. La estructura de cada uno de los dos compuestos contiene un macrociclo retorcido de 16 miembros. [19] Un paso clave en las síntesis es la formación selectiva de enlaces amida para producir el macrociclo correcto. En la síntesis enantioselectiva de Phil Baran de kapakahines B y F, se propuso que la formación de macrociclos ocurría a través de dos isómeros del sustrato. [20] El isómero más fácilmente accesible y de menor energía condujo al producto no deseado, mientras que el isómero menos estable formó el producto deseado. Sin embargo, debido a que el paso de formación del enlace amida era irreversible y la barrera para la isomerización era baja, el producto principal se derivó del intermedio de reacción más rápida. Este es un ejemplo de un escenario de Curtin-Hammett en el que el intermedio menos estable es significativamente más reactivo que el intermedio más estable que predomina en la solución. Debido a que la isomerización del sustrato es rápida, durante el transcurso de la reacción el exceso de sustrato de la forma más estable se puede convertir en la forma menos estable, que luego experimenta una rápida e irreversible formación de enlaces amida para producir el macrociclo deseado. Esta estrategia proporcionó el producto deseado con una selectividad >10:1. (Creo que hay un error en el esquema. Ver páginas de discusión).
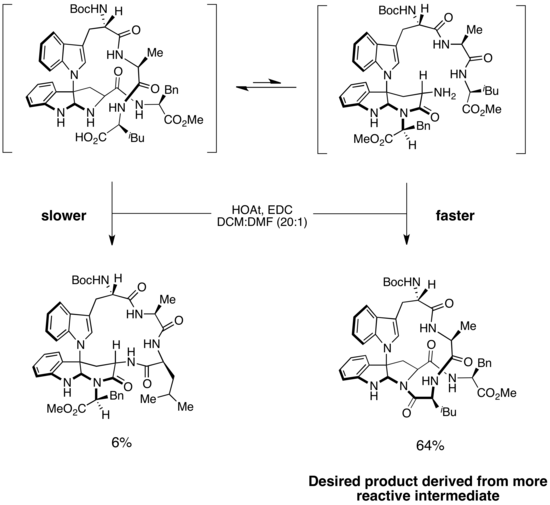
En la primera síntesis enantioselectiva de (+)-griseofulvina , un potente agente antifúngico, [21] se observó una situación de Curtin-Hammett. Un paso clave en la síntesis es la formación catalizada por rodio de un iluro de oxonio, que luego sufre una reorganización sigmatrópica [2,3] en el camino hacia el producto deseado. [22] Sin embargo, el sustrato contiene dos grupos orto-alcoxi, cualquiera de los cuales presumiblemente podría participar en la generación de iluro de oxonio.
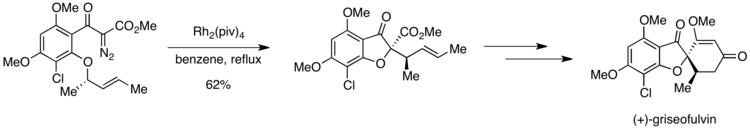
Sin embargo, fue posible obtener una alta selectividad para el producto deseado debido a las diferencias en las barreras de activación para el paso posterior a la formación del iluro. Si el grupo orto-metoxi sufre la formación de iluro de oxonio, un desplazamiento de 1,4-metilo puede generar un producto no deseado. El iluro de oxonio formado a partir del otro grupo orto-alcoxi está preparado para sufrir un reordenamiento sigmatrópico [2,3] para producir el compuesto deseado. Pirrung y colaboradores informaron de una selectividad completa para el producto deseado sobre el producto resultante de un desplazamiento de 1,4-metilo. Este resultado sugiere que la formación de iluro de oxonio es reversible, pero que el paso posterior es irreversible. El reordenamiento sigmatrópico [2,3] permitido por la simetría debe seguir una vía que tenga una energía de activación menor que el desplazamiento de 1,4-metilo, lo que explica la formación exclusiva del producto deseado.

También se encontró un posible escenario de Curtin-Hammett durante la síntesis total enantioselectiva de (+)-alociatina B2 por el grupo Trost. [23] El paso fundamental en la síntesis fue una cicloisomerización diastereoselectiva catalizada por Ru. La reacción podría dar como resultado la formación de dos posibles isómeros de doble enlace. La reacción proporcionó una buena selectividad para el isómero deseado, con resultados consistentes con un escenario de Curtin-Hammett. La ciclorutenación oxidativa inicial y la eliminación del beta-hidruro producen un hidruro de vinilo-rutenio. La inserción del hidruro permite una fácil isomerización del alqueno. Es poco probable que el resultado de la reacción refleje la estabilidad de los intermediarios, ya que el gran grupo CpRu experimenta interacciones estéricas desfavorables con el grupo isopropilo cercano. En cambio, se aplica una situación de Curtin-Hammett, en la que el isómero favorecido en el equilibrio no conduce al producto principal. La eliminación reductora se ve favorecida a partir del intermedio más reactivo y menos estable, ya que se maximiza el alivio de tensión en el estado de transición. Esto produce el isómero de doble enlace deseado.

{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )