La fundición de zinc es el proceso de convertir concentrados de zinc ( minerales que contienen zinc) en zinc puro. La fundición de zinc ha sido históricamente más difícil que la fundición de otros metales, por ejemplo, el hierro , porque, en contraste, el zinc tiene un punto de ebullición bajo . A las temperaturas que se utilizan normalmente para fundir metales, el zinc es un gas que se escapará de un horno con los gases de combustión y se perderá, a menos que se tomen medidas específicas para evitarlo.
El concentrado de zinc procesado con mayor frecuencia es el sulfuro de zinc , [1] que se obtiene mediante la concentración de esfalrita mediante el método de flotación por espuma . El material de zinc secundario (reciclado), como el óxido de zinc, también se procesa con el sulfuro de zinc. [2] Aproximadamente el 30 % de todo el zinc producido proviene de fuentes recicladas. [3]
Existen dos métodos para fundir zinc: el proceso pirometalúrgico y el proceso de electrólisis. [2] Ambos métodos todavía se utilizan. [2] [4] Ambos procesos comparten el mismo primer paso: la tostación.
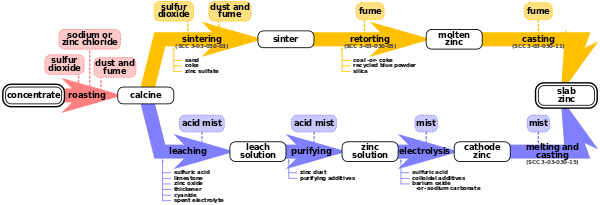
La tostación es un proceso de oxidación de concentrados de sulfuro de cinc a altas temperaturas para formar un óxido de cinc impuro, llamado "calcinación de cinc". Las reacciones químicas que se producen son las siguientes:
Aproximadamente el 90% del zinc presente en los concentrados se oxida a óxido de zinc. Sin embargo, a las temperaturas de tostado, alrededor del 10% del zinc reacciona con las impurezas de hierro de los concentrados de sulfuro de zinc para formar ferrita de zinc . Un subproducto del tostado es el dióxido de azufre , que se procesa posteriormente para obtener ácido sulfúrico , un producto básico . [2] El diagrama de flujo de la refinería vinculado muestra un esquema de la operación de tostado de zinc de Noranda en el este de Canadá [5]
El proceso de tostado varía según el tipo de tostador utilizado. Existen tres tipos de tostadores: de solera múltiple, de suspensión y de lecho fluidizado. [1]
En un tostador de múltiples soleras, el concentrado cae a través de una serie de 9 o más soleras apiladas dentro de una columna cilíndrica revestida de ladrillos. A medida que el concentrado de alimentación cae a través del horno, primero se seca por los gases calientes que pasan a través de las soleras y luego se oxida para producir calcina. Las reacciones son lentas y solo se pueden sostener mediante la adición de combustible. Los tostadores de múltiples soleras no están presurizados y funcionan a aproximadamente 690 °C (1270 °F). El tiempo de funcionamiento depende de la composición del concentrado y la cantidad de eliminación de azufre necesaria. Los tostadores de múltiples soleras tienen la capacidad de producir una calcina de alta pureza. [1]
En un tostador de suspensión, los concentrados se introducen en una cámara de combustión muy similar a la de un horno de carbón pulverizado. El tostador consta de una carcasa cilíndrica de acero revestida de material refractario, con un gran espacio de combustión en la parte superior y de 2 a 4 hogares en la parte inferior, similares a los de un horno de múltiples hogares. Normalmente se requiere una molienda adicional, además de la requerida para un horno de múltiples hogares, para garantizar que la transferencia de calor al material sea lo suficientemente rápida para que se produzcan las reacciones de desulfuración y oxidación en la cámara del horno. Los tostadores de suspensión no están presurizados y funcionan a unos 980 °C (1800 °F). [1]
En un tostador de lecho fluidizado, los concentrados de sulfuro finamente molidos se suspenden y oxidan en un lecho de materia prima soportado sobre una columna de aire. Al igual que en el tostador de suspensión, las velocidades de reacción para la desulfuración son más rápidas que en los antiguos procesos de múltiples soleras. Los tostadores de lecho fluidizado funcionan a una presión ligeramente inferior a la atmosférica y a temperaturas que promedian los 1000 °C (1830 °F). En el proceso de lecho fluidizado, no se requiere combustible adicional después de que se ha logrado la ignición. Las principales ventajas de este tostador son mayores capacidades de rendimiento, mayores capacidades de eliminación de azufre y menor mantenimiento. [1]
El proceso de electrólisis, también conocido como proceso hidrometalúrgico, proceso Roast-Leach-Electrowin (RLE) o proceso electrolítico, es más ampliamente utilizado que los procesos pirometalúrgicos. [2]
El proceso de electrólisis consta de 4 pasos: lixiviación, purificación, electrólisis y fusión y colada.
La fórmula química básica de lixiviación que impulsa este proceso es:
En la práctica, esto se logra mediante un proceso llamado doble lixiviación. Primero, la calcina se lixivia en una solución neutra o ligeramente ácida (de ácido sulfúrico) para lixiviar el zinc del óxido de zinc. Luego, la calcina restante se lixivia en ácido sulfúrico fuerte para lixiviar el resto del zinc del óxido de zinc y la ferrita de zinc. El resultado de este proceso es un sólido y un líquido; el líquido contiene el zinc y a menudo se denomina producto de lixiviación; el sólido se denomina residuo de lixiviación y contiene metales preciosos (generalmente plomo y plata) que se venden como subproducto. También hay hierro en el producto de lixiviación de la lixiviación con ácido fuerte, que se elimina en un paso intermedio, en forma de goethita , jarosita y hematita . Todavía hay cadmio , cobre , arsénico , antimonio , cobalto , germanio , níquel y talio en el producto de lixiviación. Por lo tanto, debe purificarse. [1] [2]
El proceso de purificación utiliza el proceso de cementación para purificar aún más el zinc. Utiliza polvo de zinc y vapor para eliminar el cobre, el cadmio, el cobalto y el níquel, que interferirían con el proceso de electrólisis. Después de la purificación, las concentraciones de estas impurezas se limitan a menos de 0,05 miligramos por litro (4×10 −7 libras por galón estadounidense). La purificación generalmente se lleva a cabo en grandes tanques agitados. El proceso se lleva a cabo a temperaturas que varían de 40 a 85 °C (104 a 185 °F) y presiones que varían de atmosféricas a 2,4 atm (240 kPa) (escala absoluta). Los subproductos se venden para su posterior refinación. [1] [2]
La solución de sulfato de zinc debe ser muy pura para que la electroobtención sea eficiente. Las impurezas pueden cambiar el voltaje de descomposición lo suficiente como para que la celda de electrólisis produzca principalmente gas hidrógeno en lugar de zinc metálico. [6]
El zinc se extrae de la solución de sulfato de zinc purificado mediante electroobtención , que es una forma especializada de electrólisis. El proceso funciona haciendo pasar una corriente eléctrica a través de la solución en una serie de celdas. Esto hace que el zinc se deposite en los cátodos ( láminas de aluminio ) y que se forme oxígeno en los ánodos. También se forma ácido sulfúrico en el proceso y se reutiliza en el proceso de lixiviación. Cada 24 a 48 horas, se apaga cada celda, se retiran y enjuagan los cátodos recubiertos de zinc, y el zinc se elimina mecánicamente de las placas de aluminio. [1] [2]
Las fundiciones electrolíticas de zinc contienen cientos de celdas. Una parte de la energía eléctrica se convierte en calor, lo que aumenta la temperatura del electrolito. Las celdas electrolíticas funcionan a temperaturas que van de 30 a 35 °C (86 a 95 °F) y a presión atmosférica. Una parte del electrolito circula continuamente a través de las torres de enfriamiento para enfriar y concentrar el electrolito mediante la evaporación del agua. El electrolito enfriado y concentrado se recicla luego a las celdas. [1] Este proceso representa aproximadamente un tercio de todo el uso de energía durante la fundición de zinc. [2]
Existen dos procesos comunes para la electroobtención del metal: el proceso de baja densidad de corriente y el proceso de alta densidad de corriente Tainton . El primero utiliza una solución de ácido sulfúrico al 10% como electrolito, con una densidad de corriente de 270 a 325 amperios por metro cuadrado. El segundo utiliza una solución de ácido sulfúrico al 22 a 28% como electrolito con una densidad de corriente de aproximadamente 1000 amperios por metro cuadrado. El último proporciona una mejor pureza y tiene una mayor capacidad de producción por volumen de electrolito, pero tiene la desventaja de funcionar a mayor temperatura y ser más corrosivo para el recipiente en el que se realiza. En cualquiera de los procesos electrolíticos, cada tonelada métrica de producción de zinc gasta alrededor de 3900 kW⋅h (14 GJ ) de energía eléctrica. [6]
Dependiendo del tipo de productos finales producidos, los cátodos de zinc que salen de la planta de electroobtención pueden sufrir un paso de transformación adicional en una fundición. Los cátodos de zinc se funden en hornos de inducción y se moldean para formar productos comercializables, como lingotes. Se pueden agregar otros metales y componentes de aleación para producir aleaciones que contengan zinc que se utilizan en aplicaciones de fundición a presión o galvanización general. Finalmente, el zinc fundido se puede transportar a plantas de conversión cercanas o a terceros utilizando contenedores aislados especialmente diseñados.
También existen varios procesos pirometalúrgicos que reducen el óxido de zinc utilizando carbón y luego destilan el zinc metálico de la mezcla resultante en una atmósfera de monóxido de carbono. La principal desventaja de cualquier proceso pirometalúrgico es que solo tiene una pureza del 98 %; una composición estándar es 1,3 % de plomo, 0,2 % de cadmio, 0,03 % de hierro y 98,5 % de zinc. [7] Esto puede ser lo suficientemente puro para la galvanización, pero no lo suficiente para las aleaciones de fundición a presión, que requieren zinc especial de alto grado (99,995 % de pureza). [7] Para alcanzar esta pureza, el zinc debe refinarse .
Los cuatro tipos de procesos pirometalúrgicos comerciales son el proceso (electrotérmico) de St. Joseph Minerals Corporation , el proceso de alto horno , el proceso de retorta vertical continua de New Jersey Zinc y el proceso de retorta horizontal de tipo belga .
Este proceso fue desarrollado por la St. Joseph Mineral Company en 1930 y es el único proceso pirometalúrgico que todavía se utiliza en los EE. UU. para fundir zinc. La ventaja de este sistema es que puede fundir una amplia variedad de materiales que contienen zinc, incluido el polvo de horno de arco eléctrico. [1] La desventaja de este proceso es que es menos eficiente que el proceso de electrólisis. [2]
El proceso comienza con una operación de sinterización de corriente descendente. El sinter, que es una mezcla de calcina de tostado y calcina de horno de arco eléctrico (EAF), se carga en un transportador de tipo compuerta y luego los gases de combustión se bombean a través del sinter. El carbono en los gases de combustión reacciona con algunas impurezas, como plomo, cadmio y haluros. Estas impurezas se eliminan en bolsas de filtración. El sinter después de este proceso, llamado sinter de producto, generalmente tiene una composición de 48% de zinc, 8% de hierro, 5% de aluminio, 4% de silicio, 2,5% de calcio y cantidades más pequeñas de magnesio, plomo y otros metales. Luego, el producto sinterizado se carga con coque en un horno de retorta eléctrico. Un par de electrodos de grafito de la parte superior e inferior del horno producen un flujo de corriente a través de la mezcla. El coque proporciona resistencia eléctrica a la mezcla para calentarla a 1400 °C (2550 °F) y producir monóxido de carbono. Estas condiciones permiten que ocurra la siguiente reacción química:
El vapor de zinc y el dióxido de carbono pasan a un condensador de vacío, donde el zinc se recupera burbujeando a través de un baño de zinc fundido. Más del 95% del vapor de zinc que sale de la retorta se condensa en zinc líquido. El dióxido de carbono se regenera con carbón y el monóxido de carbono se recicla de nuevo al horno de retorta. [1]
Este proceso fue desarrollado por la National Smelting Company en Avonmouth Docks , Inglaterra , con el fin de aumentar la producción, aumentar la eficiencia y reducir los costos de mano de obra y mantenimiento. LJ Derham propuso utilizar un rocío de gotas de plomo fundido para enfriar y absorber rápidamente el vapor de zinc, a pesar de la alta concentración de dióxido de carbono. Luego, la mezcla se enfría, donde el zinc se separa del plomo. La primera planta que utilizó este diseño se inauguró en 1950. Una de las ventajas de este proceso es que puede coproducir lingotes de plomo y escoria de cobre. En 1990, representó el 12% de la producción mundial de zinc.
El proceso comienza con la carga de sinter sólido y coque calentado en la parte superior del alto horno. Se inyecta aire precalentado a una temperatura de entre 190 y 1050 °C (370 y 1920 °F) en la parte inferior del horno. El vapor de cinc y los sulfuros salen por la parte superior y entran en el condensador. La escoria y el plomo se acumulan en la parte inferior del horno y se extraen periódicamente. El cinc se elimina del vapor en el condensador mediante plomo líquido. El cinc líquido se separa del plomo en el circuito de refrigeración. Para este proceso se necesitan aproximadamente 5000 toneladas métricas (5500 toneladas cortas ) de plomo al año, aunque este proceso recupera un 25 % más de plomo de los minerales de partida que otros procesos.

El proceso New Jersey Zinc [8] ya no se utiliza para producir zinc primario en los EE. UU., Europa y Japón, pero todavía se utiliza para tratar operaciones secundarias. Este proceso alcanzó su máximo auge en 1960, cuando representó el 5% de la producción mundial de zinc. Una versión modificada de este proceso todavía se utiliza en una planta de Huludao en China (originalmente establecida por los japoneses en 1937), que produjo 65.000 toneladas métricas por año a partir de 1991 [7] y aumentó la capacidad a al menos 210.000 t/año para 2023. [9]
Este proceso comienza con la tostación de concentrados que se mezclan con carbón y se convierten en briquetas en dos etapas. Luego, las briquetas se calientan en un coquizador autógeno a 700 °C (1292 °F) y luego se cargan en la retorta. Hay tres razones para convertir el calcinado en briquetas: garantizar el libre movimiento descendente de la carga; permitir la transferencia de calor a través de una sección transversal de tamaño práctico; permitir una porosidad adecuada para el paso del vapor de zinc reducido a la parte superior de la retorta. El vapor de zinc reducido que se recoge en la parte superior de la retorta se condensa luego en un líquido. [7]
Overpelt mejoró este diseño al utilizar una sola cámara de condensación grande, en lugar de muchas pequeñas, como se había diseñado originalmente. Esto permitió que el monóxido de carbono se recirculara hacia los hornos para calentar las retortas. [7]
Este proceso fue licenciado a la Imperial Smelting Corporation (ISC), con sede en Avonmouth , Inglaterra, que tuvo una gran planta de retorta vertical (VR) en producción durante muchos años. Se utilizó hasta mediados de la década de 1970, cuando fue reemplazada por la planta Imperial Smelting Furnace (ISF) de la empresa. La planta VR fue demolida en 1975.
Este proceso fue el principal utilizado en Gran Bretaña desde mediados del siglo XIX hasta 1951. [7] [10] El proceso era muy ineficiente, ya que estaba diseñado como una operación por lotes a pequeña escala. Cada retorta solo producía 40 kilogramos (88 libras), por lo que las empresas las juntaban en bancos y utilizaban un gran quemador de gas para calentarlas todas. [10] El proceso belga requiere redestilación para eliminar impurezas de plomo, cadmio, hierro, cobre y arsénico. [6]
La primera producción de zinc en grandes cantidades parece haber sido en la India a partir del siglo XII y más tarde en China a partir del siglo XVI. [11] En la India, el zinc se produjo en Zawar desde el siglo XII al XVIII, aunque algunos artefactos de zinc parecen haber sido fabricados durante la antigüedad clásica en Europa . [12] El mineral de esfalrita encontrado aquí presumiblemente se convirtió en óxido de zinc mediante tostado, aunque no se ha encontrado evidencia arqueológica de esto. Se cree que la fundición se realizó en retortas de arcilla cilíndricas selladas que se llenaron con una mezcla de mineral tostado, dolomita y un material orgánico, tal vez estiércol de vaca , y luego se colocaron verticalmente en un horno y se calentaron a alrededor de 1100 °C. El monóxido de carbono producido por la carbonización del material orgánico habría reducido el óxido de zinc a vapor de zinc, que luego se licuó en un condensador de arcilla cónico en el fondo de la retorta, goteando hacia un recipiente colector. Se estima que durante el período 1400-1800 la producción fue de unos 200 kg/día. [13] El zinc también se fundió en China desde mediados del siglo XVI. [14]
La producción de zinc a gran escala en Europa comenzó con William Champion , quien patentó un proceso de destilación de zinc en 1738. [15] En el proceso de Champion, el mineral de zinc (en este caso, el carbonato, ZnCO3 ) se sellaba en grandes ollas de reducción con carbón y se calentaba en un horno. Luego, el vapor de zinc descendía a través de una tubería de condensación de hierro hasta llegar a un recipiente lleno de agua en el fondo. [16] Champion instaló sus primeras fábricas de zinc en Bristol , Inglaterra, pero pronto se expandió a Warmley y en 1754 había construido cuatro hornos de zinc allí. [17] Aunque Champion logró producir alrededor de 200 toneladas de zinc, [17] sus planes comerciales no tuvieron éxito y se declaró en quiebra en 1769. [16] Sin embargo, la fundición de zinc continuó en esta área hasta 1880. [17]
La producción europea temprana de zinc también tuvo lugar en Silesia , en Carintia y en Lieja , Bélgica . En el proceso de Carintia, utilizado en las fábricas establecidas en 1798 por Bergrath Dillinger, un horno alimentado con leña calentaba una gran cantidad de pequeñas retortas verticales, [20] y luego el vapor de zinc caía a través de un tubo de cerámica en una cámara de condensación común debajo. Este proceso dejó de usarse en 1840. Los procesos belga y silesio usaban retortas horizontales. [21] En Silesia, Johann Ruhberg construyó un horno para destilar zinc en 1799, al principio usando ollas pero luego cambiando a retortas de fondo plano llamadas "muflas", unidas a tubos horizontales doblados hacia abajo en los que se condensaba el zinc. El proceso silesio finalmente se fusionó con el proceso belga. Este proceso, desarrollado por Jean-Jacques Daniel Dony , se introdujo entre 1805 y 1810 y utilizaba retortas con una sección transversal cilíndrica. [20] [21] Los condensadores eran tubos de arcilla horizontales que se extendían desde los extremos de las retortas. [22] El proceso de retorta horizontal "belgo-silesiano" fusionado fue ampliamente adoptado en Europa en el tercer cuarto del siglo XIX y, más tarde, en los Estados Unidos. [21]
Los intentos experimentales de extraer zinc mediante electrólisis comenzaron en el siglo XIX, pero la única aplicación comercialmente exitosa antes de 1913 fue un proceso, utilizado en Gran Bretaña y Austria , donde el zinc y el cloro se coproducían por electrólisis de una solución acuosa de cloruro de zinc . [23] La Anaconda Copper Company , en Anaconda , Montana , y la Consolidated Mining and Smelting Company , en Trail , Columbia Británica , construyeron plantas electrolíticas exitosas en 1915 utilizando el proceso de sulfato de zinc utilizado actualmente. [24] Este método ha seguido creciendo en importancia y en 1975 representó el 68% de la producción mundial de zinc. [25]
El proceso de retorta vertical continua fue introducido en 1929 por la New Jersey Zinc Company. Este proceso utilizaba una retorta con paredes de carburo de silicio, de unos 9 metros de altura y con una sección transversal de 2 por 0,3 metros. Las paredes de la retorta se calentaban a 1300 °C y se introducían en la parte superior de la retorta briquetas compuestas de mineral de zinc sinterizado, coque, carbón y material reciclado. El zinc gaseoso se extraía de la parte superior de la columna y, después de un viaje de 20 horas a través de la retorta, las briquetas gastadas se retiraban de la parte inferior. [26] Para condensar el zinc gaseoso, la empresa utilizó primero una sencilla cámara de ladrillos con deflectores de carborundo, pero la eficiencia era baja. Durante la década de 1940 se desarrolló un condensador que condensaba el vapor de zinc en un rocío de gotitas de zinc líquido, arrojadas hacia arriba por un impulsor eléctrico. [27]
El proceso electrotérmico, desarrollado por la St. Joseph's Lead Company , era algo similar. [26] [28] La primera planta comercial que utilizó este proceso se construyó en 1930 en el actual emplazamiento de Josephtown, Pensilvania . El horno electrotérmico era un cilindro de acero de unos 15 metros de altura y 2 metros de diámetro, revestido de ladrillos refractarios. Se introducía una mezcla de mineral sinterizado y coque en la parte superior del horno, y se aplicaba una corriente de 10.000 a 20.000 amperios, con una diferencia de potencial de 240 voltios, entre los electrodos de carbono del horno, lo que elevaba la temperatura a 1200-1400 °C. [26] [28] Entre 1931 y 1936 se diseñó un condensador eficiente para este proceso; consistía en un baño de zinc líquido a través del cual se aspiraban los gases de escape. El contenido de zinc de la corriente de gas se absorbía en el baño líquido. [27]
El proceso de alto horno fue desarrollado a partir de 1943 en Avonmouth, Inglaterra, por la Imperial Smelting Corporation, [29] que pasó a formar parte de Rio Tinto Zinc en 1968. [30] Utiliza una pulverización de gotas de plomo fundido para condensar el vapor de zinc. [31]