
Las tiolasas , también conocidas como acetil-coenzima A acetiltransferasas ( ACAT ), son enzimas que convierten dos unidades de acetil-CoA en acetoacetil CoA en la vía del mevalonato .
Las tiolasas son enzimas ubicuas que tienen papeles clave en muchas vías bioquímicas vitales, incluyendo la vía de beta oxidación de la degradación de ácidos grasos y varias vías biosintéticas. [1] Los miembros de la familia de las tiolasas se pueden dividir en dos grandes categorías: tiolasas degradativas (EC 2.3.1.16) y tiolasas biosintéticas (EC 2.3.1.9). Estos dos tipos diferentes de tiolasas se encuentran tanto en eucariotas como en procariotas : acetoacetil-CoA tiolasa (EC:2.3.1.9) y 3-cetoacil-CoA tiolasa (EC:2.3.1.16). La 3-cetoacil-CoA tiolasa (también llamada tiolasa I) tiene una amplia especificidad de longitud de cadena para sus sustratos y está involucrada en vías degradativas como la beta-oxidación de ácidos grasos. La acetoacetil-CoA tiolasa (también llamada tiolasa II) es específica para la tiolisis de acetoacetil-CoA y participa en vías biosintéticas como la síntesis de ácido beta-hidroxibutírico o la biogénesis de esteroides .
La formación de un enlace carbono-carbono es un paso clave en las vías biosintéticas mediante las cuales se forman los ácidos grasos y los policétidos . Las enzimas de la superfamilia de las tiolasas catalizan la formación de enlaces carbono-carbono mediante un mecanismo de reacción de condensación de Claisen dependiente de tioésteres [2] . [3]
Las tiolasas son una familia de enzimas relacionadas evolutivamente . Se encuentran dos tipos diferentes de tiolasa [4] [5] [6] tanto en eucariotas como en procariotas: acetoacetil-CoA tiolasa ( EC 2.3.1.9) y 3-cetoacil-CoA tiolasa ( EC 2.3.1.16). La 3-cetoacil-CoA tiolasa (también llamada tiolasa I) tiene una amplia especificidad de longitud de cadena para sus sustratos y está involucrada en vías degradativas como la beta-oxidación de ácidos grasos. La acetoacetil-CoA tiolasa (también llamada tiolasa II) es específica para la tiolisis de acetoacetil-CoA y está involucrada en vías biosintéticas como la síntesis de poli beta-hidroxibutirato o la biogénesis de esteroides.
En los eucariotas, existen dos formas de 3-cetoacil-CoA tiolasa: una ubicada en la mitocondria y la otra en los peroxisomas.
Existen dos residuos de cisteína conservados que son importantes para la actividad de la tiolasa. El primero, ubicado en la sección N-terminal de las enzimas, está involucrado en la formación de un intermediario acil-enzima; el segundo, ubicado en el extremo C-terminal, es la base del sitio activo que participa en la desprotonación en la reacción de condensación.
La proteína transportadora de lípidos no específica de mamíferos (nsL-TP) (también conocida como proteína transportadora de esteroles 2 ) es una proteína que parece existir en dos formas diferentes: una proteína de 14 Kd (SCP-2) y una proteína más grande de 58 Kd (SCP-x). La primera se encuentra en el citoplasma o las mitocondrias y está involucrada en el transporte de lípidos; la segunda se encuentra en los peroxisomas . La parte C-terminal de SCP-x es idéntica a SCP-2 mientras que la porción N-terminal está relacionada evolutivamente con las tiolasas. [6]

Los tioésteres son más reactivos que los ésteres de oxígeno y son intermediarios comunes en el metabolismo de los ácidos grasos. [7] Estos tioésteres se forman conjugando el ácido graso con el grupo SH libre de la fracción panteteína de la coenzima A (CoA) o de la proteína transportadora de acilo (ACP).
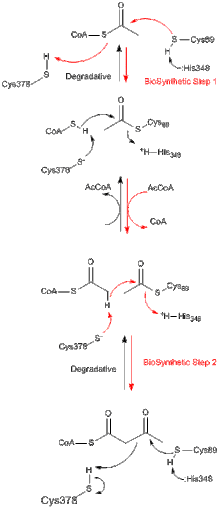
Todas las tiolasas, ya sean biosintéticas o degradativas in vivo, catalizan preferentemente la degradación de 3-cetoacil-CoA para formar acetil-CoA y una especie de acil-CoA acortada, pero también son capaces de catalizar la reacción de condensación de Claisen inversa (lo que refleja el cambio de energía de Gibbs negativo de la degradación, que es independiente de la tiolasa que cataliza la reacción). Está bien establecido a partir de estudios sobre la tiolasa biosintética de Z. ramigera que la reacción de la tiolasa ocurre en dos pasos y sigue una cinética de ping-pong. [8] En el primer paso de las reacciones degradativas y biosintéticas, el nucleófilo Cys89 (o su equivalente) ataca el sustrato acil-CoA (o 3-cetoacil-CoA), lo que lleva a la formación de un intermediario acil-enzima covalente. [9] En el segundo paso, la adición de CoA (en la reacción degradativa) o acetil-CoA (en la reacción biosintética) al intermediario acil-enzima desencadena la liberación del producto de la enzima. [10] Cada uno de los intermediarios de reacción tetraédricos que ocurren durante la transferencia de un grupo acetilo hacia y desde la cisteína nucleófila, respectivamente, se han observado en estructuras cristalinas de rayos X de tiolasa biosintética de A. fumigatus. [11]
La mayoría de las enzimas de la superfamilia de las tiolasas son dímeros . Sin embargo, no se han observado monómeros. Los tetrámeros se observan solo en la subfamilia de las tiolasas y, en estos casos, los dímeros se han dimerizado para convertirse en tetrámeros. La estructura cristalina de la tiolasa biosintética tetramérica de Zoogloea ramigera se ha determinado con una resolución de 2,0 Å. La estructura contiene un sorprendente y novedoso motivo de tetramerización "similar a una jaula", que permite cierto movimiento de bisagra de los dos dímeros apretados uno con respecto al otro. El tetrámero enzimático está acetilado en Cys89 y tiene una molécula de CoA unida en cada uno de los bolsillos de su sitio activo. [12]
En las células eucariotas , especialmente en las células de mamíferos, las tiolasas exhiben diversidad en la localización intracelular relacionada con sus funciones metabólicas así como en la especificidad del sustrato. Por ejemplo, contribuyen a la β-oxidación de ácidos grasos en peroxisomas y mitocondrias , al metabolismo de cuerpos cetónicos en mitocondrias, [13] y a los primeros pasos de la vía del mevalonato en peroxisomas y citoplasma . [14] Además de las investigaciones bioquímicas, los análisis de trastornos genéticos han dejado en claro la base de sus funciones. [15] Los estudios genéticos han identificado un sistema de tres tiolasas en la levadura Candida tropicalis , que tiene actividad de tiolasa en peroxisomas, donde puede participar en la beta oxidación, y en el citosol, donde participa en la vía del mevalonato. [16] [17] La tiolasa es de importancia central en vías enzimáticas clave como la síntesis de ácidos grasos, esteroides y policétidos. La comprensión detallada de su biología estructural es de gran relevancia médica, por ejemplo, para una mejor comprensión de las enfermedades causadas por deficiencias genéticas de estas enzimas y para el desarrollo de nuevos antibióticos. [18] Aprovechar la complicada versatilidad catalítica de las policétido sintasas para la síntesis de productos naturales biológica y médicamente relevantes es también una importante perspectiva futura de los estudios de las enzimas de esta superfamilia. [19]
La deficiencia de acetoacetil-CoA tiolasa mitocondrial, conocida anteriormente como deficiencia de β-cetotiolasa , [20] es un error congénito del metabolismo que afecta al catabolismo de la isoleucina y al metabolismo de los cuerpos cetónicos. Las principales manifestaciones clínicas de este trastorno son la cetoacidosis intermitente , pero las consecuencias clínicas a largo plazo, aparentemente benignas, no están bien documentadas. La deficiencia de acetoacetil-CoA tiolasa mitocondrial se diagnostica fácilmente mediante un análisis de ácidos orgánicos urinarios y se puede confirmar mediante un análisis enzimático de fibroblastos cutáneos cultivados o leucocitos sanguíneos. [21]
La deficiencia de β-cetotiolasa tiene una presentación variable. La mayoría de los pacientes afectados se presentan entre los 5 y 24 meses de edad con síntomas de cetoacidosis grave. Los síntomas pueden iniciarse por una carga de proteína dietética, infección o fiebre. Los síntomas progresan desde vómitos hasta deshidratación y cetoacidosis. [22] Puede haber neutropenia y trombocitopenia, así como hiperamonemia moderada. La glucosa en sangre suele ser normal, pero puede ser baja o alta en episodios agudos. [23] Puede producirse un retraso en el desarrollo, incluso antes del primer episodio agudo, y se ha observado necrosis estriatal bilateral de los ganglios basales en la resonancia magnética cerebral .