El metanol (también llamado alcohol metílico y alcohol de madera , entre otros nombres) es un compuesto químico orgánico y el alcohol alifático más simple , con la fórmula química C H 3 OH (un grupo metilo unido a un grupo hidroxilo , a menudo abreviado como MeOH ). Es un líquido ligero, volátil , incoloro e inflamable con un olor alcohólico distintivo similar al del etanol (alcohol potable), pero es más agudamente tóxico que este último. [17] El metanol adquirió el nombre de alcohol de madera porque alguna vez se produjo principalmente por la destilación destructiva de la madera . Hoy en día, el metanol se produce principalmente industrialmente por hidrogenación de monóxido de carbono . [18]
El metanol está formado por un grupo metilo unido a un grupo hidroxilo polar. Se producen más de 20 millones de toneladas al año y se utiliza como precursor de otros productos químicos básicos , como el formaldehído , el ácido acético , el metil tert-butil éter , el metil benzoato , el anisol , los peroxiácidos y una serie de productos químicos más especializados. [18]
En los seres humanos normales y sanos se encuentran pequeñas cantidades de metanol. Un estudio encontró una media de 4,5 ppm en el aliento exhalado de los sujetos de prueba. [19] La media de metanol endógeno en los seres humanos de 0,45 g/d puede metabolizarse a partir de la pectina presente en la fruta; un kilogramo de manzana produce hasta 1,4 g de pectina (0,6 g de metanol). [20]
El metanol es producido por bacterias anaeróbicas y fitoplancton . [21] [22]
El metanol también se encuentra en cantidades abundantes en las regiones del espacio donde se forman estrellas y se utiliza en astronomía como marcador de dichas regiones. Se detecta a través de sus líneas de emisión espectral. [23]
En 2006, los astrónomos que utilizaron el conjunto de radiotelescopios MERLIN en el Observatorio Jodrell Bank descubrieron una gran nube de metanol en el espacio de 0,463 terametros (288 millones de millas) de diámetro. [24] [25] En 2016, los astrónomos detectaron metanol en un disco de formación planetaria alrededor de la joven estrella TW Hydrae utilizando el radiotelescopio Atacama Large Millimeter Array . [26]
En su proceso de embalsamamiento , los antiguos egipcios utilizaban una mezcla de sustancias, entre ellas el metanol, que obtenían de la pirólisis de la madera. Sin embargo, el metanol puro fue aislado por primera vez en 1661 por Robert Boyle , cuando lo produjo mediante la destilación de boj . [27] Más tarde se lo conoció como "alcohol piroxílico". En 1834, los químicos franceses Jean-Baptiste Dumas y Eugène Peligot determinaron su composición elemental. [28]
También introdujeron la palabra "metileno" en la química orgánica, formándola del griego methy = "líquido alcohólico" + hȳlē = "bosque, madera, material". "Metileno" designaba un "radical" que tenía alrededor de un 14% de hidrógeno en peso y contenía un átomo de carbono. Este sería CH 2 , pero en ese momento se pensaba que el carbono tenía un peso atómico solo seis veces el del hidrógeno, por lo que dieron la fórmula como CH. [28] Luego llamaron al alcohol de madera (l'esprit de bois) "bihidrato de méthylène" (bihidrato porque pensaron que la fórmula era C 4 H 8 O 4 o (CH) 4 (H 2 O) 2 ). El término "metilo" se derivó alrededor de 1840 por retroformación a partir de "metileno", y luego se aplicó para describir el "alcohol metílico". Esto se acortó a "metanol" en 1892 por la Conferencia Internacional de Nomenclatura Química . [29] El sufijo -ilo , que en química orgánica forma nombres de grupos de carbono , proviene de la palabra metilo .
El químico francés Paul Sabatier presentó el primer proceso que podía utilizarse para producir metanol de forma sintética en 1905. Este proceso sugería que el dióxido de carbono y el hidrógeno podían reaccionar para producir metanol. [9] Los químicos alemanes Alwin Mittasch y Mathias Pier, que trabajaban para Badische-Anilin & Soda-Fabrik (BASF), desarrollaron un medio para convertir el gas de síntesis (una mezcla de monóxido de carbono , dióxido de carbono e hidrógeno ) en metanol y recibieron una patente. Según Bozzano y Manenti, el proceso de BASF se utilizó por primera vez en Leuna , Alemania, en 1923. Las condiciones de funcionamiento consistían en temperaturas "altas" (entre 300 y 400 °C) y presiones (entre 250 y 350 atm) con un catalizador de óxido de zinc / cromo . [30]
La patente estadounidense 1.569.775 ( US 1569775 ) se solicitó el 4 de septiembre de 1924 y se concedió el 12 de enero de 1926 a BASF; el proceso utilizaba un catalizador de óxido de cromo y manganeso con condiciones extremadamente rigurosas: presiones que oscilaban entre 50 y 220 atm y temperaturas de hasta 450 °C. La producción moderna de metanol se ha vuelto más eficiente mediante el uso de catalizadores (comúnmente de cobre) capaces de operar a presiones más bajas. El moderno proceso de metanol a baja presión (LPM) fue desarrollado por ICI a finales de la década de 1960 (US 3326956) , cuya patente tecnológica expiró hace mucho tiempo.
Durante la Segunda Guerra Mundial , el metanol se utilizó como combustible en varios diseños de cohetes militares alemanes, bajo el nombre de M-Stoff , y en una mezcla aproximadamente 50/50 con hidracina , conocida como C-Stoff .
El uso de metanol como combustible para motores recibió atención durante las crisis del petróleo de la década de 1970. A mediados de la década de 1990, se introdujeron en los EE. UU. más de 20 000 " vehículos de combustible flexible " (FFV) de metanol capaces de funcionar con metanol o gasolina. Además, se mezclaron niveles bajos de metanol en los combustibles de gasolina vendidos en Europa durante gran parte de la década de 1980 y principios de la de 1990. Los fabricantes de automóviles dejaron de construir FFV de metanol a fines de la década de 1990 y dirigieron su atención a los vehículos alimentados con etanol. Si bien el programa de FFV de metanol fue un éxito técnico, el aumento de los precios del metanol a mediados y fines de la década de 1990 durante un período de caída de los precios de la gasolina en los surtidores disminuyó el interés en los combustibles de metanol . [31]
A principios de la década de 1970, Mobil desarrolló un proceso para producir combustible de gasolina a partir de metanol. [32]
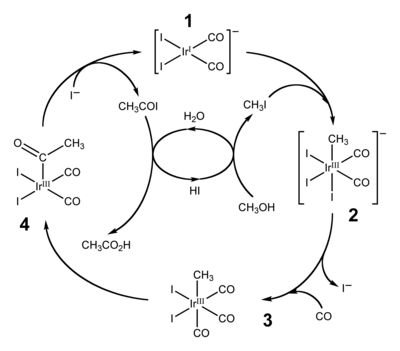
Entre los años 1960 y 1980, el metanol surgió como precursor de las sustancias químicas de base ácido acético y anhídrido acético . Estos procesos incluyen la síntesis de ácido acético de Monsanto , el proceso Cativa y el proceso de anhídrido acético de Tennessee Eastman .
El metanol se convierte principalmente en formaldehído, que se utiliza ampliamente en muchas áreas, especialmente en polímeros . La conversión implica oxidación:
El ácido acético se puede producir a partir de metanol.
El metanol y el isobuteno se combinan para formar metil terc -butil éter (MTBE). El MTBE es un importante potenciador del octanaje en la gasolina.
La condensación de metanol para producir hidrocarburos e incluso sistemas aromáticos es la base de varias tecnologías relacionadas con la conversión de gas a líquido . Estas incluyen metanol a hidrocarburos (MtH), metanol a gasolina (MtG), metanol a olefinas (MtO) y metanol a propileno (MtP). Estas conversiones son catalizadas por zeolitas como catalizadores heterogéneos . El proceso MtG se comercializó en su momento en Motunui , Nueva Zelanda. [34] [35]
La Directiva Europea sobre la Calidad de los Combustibles permite a los productores de combustible mezclar hasta un 3% de metanol, con una cantidad igual de codisolvente, con la gasolina vendida en Europa. En 2019, se estima que China utilizó hasta 7 millones de toneladas de metanol como combustible para el transporte, lo que representa más del 5% de su parque de combustibles. [36]
El metanol es el precursor de la mayoría de las metilaminas , haluros de metilo y éteres de metilo simples. [18] Los ésteres de metilo se producen a partir del metanol, incluida la transesterificación de grasas y la producción de biodiésel mediante transesterificación . [37] [38]
El metanol es un portador de energía prometedor porque, como líquido, es más fácil de almacenar que el hidrógeno y el gas natural. Sin embargo, su densidad energética es menor que la del metano , por kg. Su densidad energética de combustión es de 15,6 MJ / L ( LHV ), mientras que la del etanol es de 24 y la de la gasolina es de 33 MJ/L.
Otras ventajas del metanol son su fácil biodegradabilidad y su baja toxicidad ambiental. No persiste ni en ambientes aeróbicos (con presencia de oxígeno) ni anaeróbicos (sin oxígeno). La vida media del metanol en las aguas subterráneas es de sólo uno a siete días, mientras que muchos componentes comunes de la gasolina tienen vidas medias de cientos de días (como el benceno , de 10 a 730 días). Dado que el metanol es miscible con agua y biodegradable, es poco probable que se acumule en las aguas subterráneas, las aguas superficiales, el aire o el suelo. [39]
El metanol se utiliza ocasionalmente para alimentar motores de combustión interna . Al quemarse, se forma dióxido de carbono y agua:
Se ha propuesto el uso de metanol como combustible para el transporte terrestre. La principal ventaja de una economía basada en metanol es que podría adaptarse a los motores de combustión interna de gasolina con una modificación mínima de los motores y de la infraestructura que transporta y almacena el combustible líquido. Sin embargo, su densidad energética es menor que la de la gasolina, lo que significa que se requerirían repostajes más frecuentes. Sin embargo, es equivalente a la gasolina de octano superalto en caballos de fuerza, y la mayoría de los sistemas de inyección de combustible controlados por computadora modernos ya pueden utilizarlo. [40]
El metanol es un combustible alternativo para los barcos que ayuda a la industria naviera a cumplir con las cada vez más estrictas normas sobre emisiones. Reduce significativamente las emisiones de óxidos de azufre (SOx), óxidos de nitrógeno (NOx) y material particulado. El metanol se puede utilizar con alta eficiencia en los motores diésel marinos después de realizar pequeñas modificaciones utilizando una pequeña cantidad de combustible piloto (combustible dual). [41] [42]
En China, el metanol se utiliza como combustible para calderas industriales, que se utilizan ampliamente para generar calor y vapor para diversas aplicaciones industriales y calefacción residencial. Su uso está desplazando al carbón, que se encuentra bajo presión debido a regulaciones ambientales cada vez más estrictas. [43]
Las celdas de combustible de metanol directo son únicas por su funcionamiento a baja temperatura y presión atmosférica, lo que les permite ser muy miniaturizadas. [44] [45] Esto, combinado con el almacenamiento y manejo relativamente fácil y seguro del metanol, puede abrir la posibilidad de productos electrónicos de consumo alimentados por celdas de combustible , como computadoras portátiles y teléfonos móviles. [46]
El metanol también es un combustible muy utilizado en hornillas para acampar y navegar. El metanol arde bien en un quemador sin presión, por lo que las hornillas de alcohol suelen ser muy sencillas, a veces con poco más de una taza para contener el combustible. Esta falta de complejidad las convierte en las favoritas de los excursionistas que pasan mucho tiempo en la naturaleza. De manera similar, el alcohol se puede gelificar para reducir el riesgo de fugas o derrames, como en el caso de la marca " Sterno ".
El metanol se mezcla con agua y se inyecta en motores diésel y gasolina de alto rendimiento para aumentar la potencia y disminuir la temperatura del aire de admisión en un proceso conocido como inyección de agua y metanol .
El metanol se utiliza como desnaturalizante del etanol, y el producto se conoce como "alcohol desnaturalizado" o "alcohol desnaturalizado". Este producto se utilizó habitualmente durante la prohibición estadounidense para desalentar el consumo de licor ilegal y acabó provocando varias muertes. [47]
El metanol se utiliza como disolvente y como anticongelante en tuberías y líquido lavaparabrisas . El metanol se utilizó como anticongelante refrigerante de automóviles a principios del siglo XX. [48] A partir de mayo de 2018, el metanol quedó prohibido en la UE para su uso en el lavado o descongelación de parabrisas debido a su riesgo de consumo humano [49] [50] como resultado de las intoxicaciones por metanol en la República Checa en 2012. [ 51]
En algunas plantas de tratamiento de aguas residuales , se añade una pequeña cantidad de metanol a las aguas residuales para proporcionar una fuente de alimento de carbono para las bacterias desnitrificantes , que convierten los nitratos en gas nitrógeno y reducen la nitrificación de los acuíferos sensibles .
El metanol se utiliza como agente decolorante en la electroforesis en gel de poliacrilamida .
El monóxido de carbono y el hidrógeno reaccionan sobre un catalizador para producir metanol. Hoy en día, el catalizador más utilizado es una mezcla de óxidos de cobre y zinc , soportada sobre alúmina , como la que utilizó por primera vez ICI en 1966. A 5–10 MPa (50–100 atm) y 250 °C (482 °F), la reacción
Se caracteriza por una alta selectividad (>99,8%). La producción de gas de síntesis a partir de metano produce tres moles de hidrógeno por cada mol de monóxido de carbono, mientras que la síntesis consume solo dos moles de gas hidrógeno por mol de monóxido de carbono. Una forma de lidiar con el exceso de hidrógeno es inyectar dióxido de carbono en el reactor de síntesis de metanol, donde también reacciona para formar metanol según la ecuación
En términos de mecanismo, el proceso ocurre a través de la conversión inicial de CO en CO 2 , que luego se hidrogena : [52]
donde el subproducto H2O se recicla a través de la reacción de desplazamiento de agua-gas
Esto da una reacción general
que es lo mismo que se indica anteriormente. En un proceso estrechamente relacionado con la producción de metanol a partir de gas de síntesis, se puede utilizar directamente una alimentación de hidrógeno y CO2 . [53] La principal ventaja de este proceso es que se podría utilizar el CO2 capturado y el hidrógeno obtenido de la electrólisis, eliminando la dependencia de los combustibles fósiles .
La conversión catalítica de metano en metanol se lleva a cabo mediante enzimas, entre ellas las metanomonooxigenasas . Estas enzimas son oxigenasas de función mixta, es decir, la oxigenación está asociada a la producción de agua [54] y NAD + : [55]
Se han caracterizado enzimas dependientes tanto de Fe como de Cu. [55] Se han realizado esfuerzos intensos pero en gran medida infructuosos para emular esta reactividad. [56] [57] El metanol se oxida más fácilmente que el metano como materia prima, por lo que las reacciones tienden a no ser selectivas. Existen algunas estrategias para evitar este problema. Los ejemplos incluyen sistemas Shilov y zeolitas que contienen Fe y Cu. [58] Estos sistemas no necesariamente imitan los mecanismos empleados por las metaloenzimas , pero se inspiran en ellos. Los sitios activos pueden variar sustancialmente de los conocidos en las enzimas. Por ejemplo, se propone un sitio activo dinuclear en la enzima sMMO , mientras que se propone un hierro mononuclear ( alfa-oxígeno ) en la zeolita Fe. [59]
Se estima que las emisiones globales de metanol de las plantas oscilan entre 180 y 250 millones de toneladas por año. [60] Esta cifra es entre dos y tres veces mayor que la producción industrial de metanol provocada por el hombre.
A partir de 2023, el 0,2% de la producción mundial de metanol se produce en formas que tienen emisiones de gases de efecto invernadero relativamente bajas; esto se conoce como metanol "verde". [61] La mayor parte del metanol verde se produce a partir de la gasificación de biomasa . [61] El gas de síntesis se produce a partir de la gasificación de biomasa y luego se convierte en metanol verde. [62]
Otro método para producir metanol verde implica combinar hidrógeno, dióxido de carbono y un catalizador bajo altas temperaturas y presión. [61] Para clasificarse como metanol verde, el hidrógeno debe ser hidrógeno verde , que se produce utilizando electricidad renovable. [61] Además, el dióxido de carbono en este proceso debe ser un producto de la captura y almacenamiento de carbono o captura directa de aire o biomasa de origen reciente. [61] Algunas definiciones de metanol verde especifican que el dióxido de carbono debe capturarse durante la quema de bioenergía . [63]
El metanol se encuentra disponible comercialmente en varios grados de pureza. El metanol comercial se clasifica generalmente según los grados de pureza A y AA de ASTM. Tanto la pureza de grado A como la de grado AA son del 99,85 % de metanol en peso. El metanol de grado "AA" también contiene trazas de etanol. [30]
El metanol para uso químico normalmente corresponde al grado AA. Además del agua, las impurezas típicas incluyen acetona y etanol (que son muy difíciles de separar por destilación). La espectroscopia UV-VIS es un método conveniente para detectar impurezas aromáticas. El contenido de agua se puede determinar mediante la titulación Karl-Fischer .
El metanol es altamente inflamable. Sus vapores son ligeramente más pesados que el aire y pueden viajar hasta una fuente de ignición distante y encenderse. Los incendios de metanol deben extinguirse con polvo químico seco , dióxido de carbono , agua pulverizada o espuma resistente al alcohol. [12] Las llamas de metanol son invisibles a la luz del día.
La ingestión de tan sólo 10 ml (0,34 onzas líquidas estadounidenses) de metanol puro puede causar ceguera permanente por destrucción del nervio óptico . 30 ml (1,0 onzas líquidas estadounidenses) son potencialmente fatales. [64] La dosis letal media es de 100 ml (3,4 onzas líquidas estadounidenses), es decir , 1-2 ml/kg de peso corporal de metanol puro. [65] La dosis de referencia para el metanol es de 0,5 mg/kg en un día. [66] [67] Los efectos tóxicos comienzan horas después de la ingestión, y los antídotos a menudo pueden prevenir el daño permanente. [64] Debido a sus similitudes tanto en apariencia como en olor con el etanol (el alcohol en las bebidas) o el alcohol isopropílico , es difícil diferenciar entre los tres. [68]
El metanol es tóxico por dos mecanismos. En primer lugar, el metanol puede ser mortal debido a los efectos sobre el sistema nervioso central, actuando como un depresor del sistema nervioso central de la misma manera que el envenenamiento por etanol . En segundo lugar, en un proceso de intoxicación , se metaboliza a ácido fórmico (que está presente como el ion formato) a través del formaldehído en un proceso iniciado por la enzima alcohol deshidrogenasa en el hígado . [69] El metanol se convierte en formaldehído a través de la alcohol deshidrogenasa (ADH) y el formaldehído se convierte en ácido fórmico (formiato) a través de la aldehído deshidrogenasa (ALDH). La conversión a formato a través de la ALDH procede completamente, sin que quede formaldehído detectable. [70] El formato es tóxico porque inhibe la citocromo c oxidasa mitocondrial , causando hipoxia a nivel celular y acidosis metabólica , entre una variedad de otras alteraciones metabólicas. [71]
Los brotes de intoxicación por metanol se han producido principalmente debido a la contaminación del alcohol consumido . Esto es más común en el mundo en desarrollo . [72] Sin embargo, en 2013 se produjeron más de 1700 casos en los Estados Unidos. Los afectados suelen ser hombres adultos. [73] Los resultados pueden ser buenos con un tratamiento temprano. [74] La toxicidad del metanol se describió ya en 1856. [75]
Debido a sus propiedades tóxicas, el metanol se utiliza con frecuencia como aditivo desnaturalizante del etanol fabricado para usos industriales. Esta adición de metanol exime al etanol industrial (comúnmente conocido como " alcohol desnaturalizado " o "alcohol desnaturalizado") del impuesto especial sobre bebidas alcohólicas en los Estados Unidos y otros países.
El metóxido es un anión orgánico que es la base conjugada del metanol. ... Es una base conjugada de un metanol.
p. 398: 15. Los alcoholes y los fenoles reciben su nombre del hidrocarburo del que derivan, terminado con el sufijo
ol
(p. ej. pentanol, pentenol, etc.).