La importina es un tipo de carioferina [1] que transporta moléculas de proteínas desde el citoplasma de la célula hasta el núcleo . Lo hace uniéndose a secuencias de reconocimiento específicas , llamadas secuencias de localización nuclear (NLS).
La importina tiene dos subunidades, la importina α y la importina β. Los miembros de la familia importina-β pueden unirse y transportar carga por sí mismos, o pueden formar heterodímeros con importina-α. Como parte de un heterodímero , la importina-β media en las interacciones con el complejo de poros , mientras que la importina-α actúa como una proteína adaptadora para unirse a la señal de localización nuclear (NLS) en la carga. El trímero NLS-Importin α-Importin β se disocia después de unirse a Ran GTP dentro del núcleo , [2] y las dos proteínas importina se reciclan al citoplasma para su uso posterior.
La importina puede existir como heterodímero de importina-α/β o como monómero de Importina-β. Importin-α fue aislado por primera vez en 1994 por un grupo que incluía a Enno Hartmann, con sede en el Centro Max Delbrück de Medicina Molecular . [1] El proceso de importación de proteínas nucleares ya se había caracterizado en revisiones anteriores, [3] pero las proteínas clave involucradas no se habían dilucidado hasta ese momento. Se purificó a partir de huevos de Xenopus una proteína citosólica de 60 kDa , esencial para la importación de proteínas al núcleo y con una identidad de secuencia del 44 % con SRP1p . Fue clonado, secuenciado y expresado en E. coli y para reconstituir completamente el transporte dependiente de la señal, tuvo que combinarse con Ran (TC4). En el estudio también se encontraron otros factores estimulantes clave. [1]
La importina-β, a diferencia de la importina-α, no tiene homólogos directos en la levadura, pero se purificó como una proteína de 90-95 kDa y se encontró que formaba un heterodímero con la importina-α en varios casos diferentes. Entre ellos se encontraba un estudio dirigido por Michael Rexach [4] y otros estudios de Dirk Görlich. [5] Estos grupos descubrieron que la importina-α requiere otra proteína, la importina-β, para funcionar, y que juntas forman un receptor para señales de localización nuclear (NLS) , permitiendo así el transporte al núcleo . Desde estos descubrimientos iniciales en 1994 y 1995, se ha descubierto una gran cantidad de genes Importin, como IPO4 e IPO7 , que facilitan la importación de proteínas de carga ligeramente diferentes, debido a su diferente estructura y localidad.
Una gran proporción de la proteína adaptadora importina-α está formada por varias repeticiones de armadillo (ARM) dispuestas en tándem . Estas repeticiones se pueden apilar para formar una estructura de forma curva, lo que facilita la unión al NLS de proteínas de carga específicas. El sitio de unión principal de NLS se encuentra hacia el extremo N , y un sitio menor se encuentra en el extremo C. Además de las estructuras ARM , Importin-α también contiene una región N-terminal de 90 aminoácidos , responsable de la unión a Importin-β, conocida como dominio de unión de Importin-β (IBB). [6] Este también es un sitio de autoinhibición, [7] y está implicado en la liberación de carga una vez que la importina-α llega al núcleo . [8]
Importin-β es la estructura típica de una superfamilia más grande de carioferinas . La base de su estructura son 18-20 repeticiones en tándem del motivo HEAT . Cada una de estas repeticiones contiene dos hélices alfa antiparalelas unidas por una vuelta , que se apilan para formar la estructura general de la proteína . [9]
Para transportar carga al núcleo , la importina-β debe asociarse con los complejos de poros nucleares . Lo hace formando enlaces débiles y transitorios con nucleoporinas en sus diversos motivos F G (Phe-Gly). El análisis cristalográfico ha demostrado que estos motivos se unen a la importina-β en bolsas hidrofóbicas poco profundas que se encuentran en su superficie. [10]
La función principal de la importina es mediar en la translocación de proteínas con señales de localización nuclear hacia el núcleo , a través de complejos de poros nucleares (NPC) , en un proceso conocido como ciclo de importación de proteínas nucleares.
El primer paso de este ciclo es el amarre de la carga. La importina puede realizar esta función como una proteína importina-β monomérica , pero generalmente requiere la presencia de importina-α, que actúa como un adaptador para las proteínas de carga (a través de interacciones con el NLS ). La NLS es una secuencia de aminoácidos básicos que etiqueta a la proteína como carga destinada al núcleo . Una proteína de carga puede contener uno o dos de estos motivos , que se unirán a los sitios de unión mayor y/o menor de la importina-α. [11]
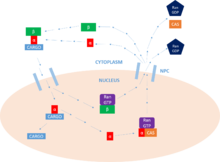
Una vez que se une la proteína de carga, la importina-β interactúa con el NPC y el complejo se difunde hacia el núcleo desde el citoplasma . La velocidad de difusión depende tanto de la concentración de importina-α presente en el citoplasma como de la afinidad de unión de la importina-α a la carga. Una vez dentro del núcleo , el complejo interactúa con la GTPasa de la familia Ras , Ran-GTP . Esto conduce a la disociación del complejo alterando la conformación de importina-β. Importin-β queda unida a Ran - GTP , lista para ser reciclada. [11]
Ahora que el complejo importina-α/carga está libre de importina-β, la proteína carga puede liberarse en el núcleo . "El dominio N-terminal de unión a importina-β (IBB) de importina-α contiene una región autorreguladora que imita el motivo NLS ". [7] La liberación de importina-β libera esta región y le permite retroceder y competir por la unión con la proteína de carga en el sitio principal de unión a NLS . Esta competencia conduce a la liberación de la proteína . En algunos casos, también se pueden emplear factores de liberación específicos, como Nup2 y Nup50 , para ayudar a liberar la carga. [11]
Finalmente, para regresar al citoplasma , la importina-α debe asociarse con un complejo Ran-GTP / CAS (factor de exportación nuclear) que facilita su salida del núcleo . CAS (proteína de susceptibilidad a la apoptosis celular) es parte de la superfamilia de carioferinas importina-β y se define como un factor de exportación nuclear. Importin-β regresa al citoplasma , todavía unida a Ran - GTP . Una vez en el citoplasma , Ran - GTP es hidrolizado por Ran GAP , formando Ran - GDP y liberando las dos importinas para una mayor actividad. Es esta hidrólisis del GTP la que proporciona la energía para el ciclo en su conjunto. En el núcleo , un GEF cargará a Ran con una molécula de GTP , que luego es hidrolizada por un GAP en el citoplasma , como se indicó anteriormente. Es esta actividad de Ran la que permite el transporte unidireccional de proteínas . [11]
Existen varios estados patológicos y patologías que están asociados con mutaciones o cambios en la expresión de importina-α e importina-β.
Las importinas son proteínas reguladoras vitales durante los procesos de gametogénesis y embriogénesis . Como resultado, se ha demostrado que una alteración en los patrones de expresión de importina-α causa defectos de fertilidad en Drosophila melanogaster . [12]
También se han realizado estudios que relacionan la importina-α alterada con algunos casos de cáncer . Los estudios sobre el cáncer de mama han implicado una forma truncada de importina-α en la que falta el dominio de unión NLS . [13] Además, se ha demostrado que la importina-α transporta el gen supresor de tumores , BRCA1 (proteína de susceptibilidad al cáncer de mama tipo 1) , al núcleo . La sobreexpresión de importina-α también se ha relacionado con bajas tasas de supervivencia observadas en ciertos pacientes con melanoma . [14]
La actividad de la importina también está asociada con algunas patologías virales . Por ejemplo, en la vía de infección del virus del Ébola , un paso clave es la inhibición de la importación nuclear de PY-STAT1 . Esto se logra porque el virus secuestra la importina-α en el citoplasma , lo que significa que ya no puede unirse a su carga en el NLS . [15] Como resultado, la importina no puede funcionar y la proteína de carga permanece en el citoplasma.
La importina puede transportar muchas proteínas de carga diferentes al núcleo . A menudo, diferentes proteínas requerirán diferentes combinaciones de α y β para poder translocarse. A continuación se enumeran algunos ejemplos de diferentes cargas.
Aunque importina-α e importina-β se utilizan para describir la importina en su conjunto, en realidad representan familias más grandes de proteínas que comparten una estructura y función similares. Se han identificado varios genes diferentes tanto para α como para β, y algunos de ellos se enumeran a continuación. Tenga en cuenta que a menudo la carioferina y la importina se utilizan indistintamente.