El hexametilbenceno , también conocido como meliteno , es un hidrocarburo con la fórmula molecular C 12 H 18 y la fórmula estructural condensada C 6 (CH 3 ) 6 . Es un compuesto aromático y un derivado del benceno , donde los seis átomos de hidrógeno del benceno han sido reemplazados cada uno por un grupo metilo . En 1929, Kathleen Lonsdale informó la estructura cristalina del hexametilbenceno, demostrando que el anillo central es hexagonal y plano [1] y poniendo así fin a un debate en curso sobre los parámetros físicos del sistema del benceno. Este fue un resultado históricamente significativo, tanto para el campo de la cristalografía de rayos X como para la comprensión de la aromaticidad . [2] [3]
El hexametilbenceno se puede oxidar a ácido melítico , [4] que se encuentra en la naturaleza como su sal de aluminio en el mineral raro melita . [5] El hexametilbenceno se puede utilizar como ligando en compuestos organometálicos . [6] Un ejemplo de la química del organorutenio muestra un cambio estructural en el ligando asociado con cambios en el estado de oxidación del centro metálico, [7] [8] aunque no se observa el mismo cambio en el sistema organohierro análogo . [7]
En 2016 se determinó la estructura cristalina del dicatión de hexametilbenceno C
6(ES
3)2+
6Se informó en Angewandte Chemie International Edition , [9] mostrando una estructura piramidal en la que un solo átomo de carbono tiene una interacción de enlace con otros seis átomos de carbono. [10] [11] Esta estructura no tenía precedentes, [9] ya que la valencia máxima habitual del carbono es cuatro, y atrajo la atención de New Scientist , [10] Chemical & Engineering News , [11] y Science News . [12] La estructura no viola la regla del octeto ya que los enlaces carbono-carbono formados no son enlaces de dos electrones, y es pedagógicamente valiosa para ilustrar que un átomo de carbono "puede [unirse directamente] con más de cuatro átomos". [12] Steven Bachrach ha demostrado que el compuesto es hipercoordinado pero no hipervalente , y también explicó su aromaticidad. [13] La idea de describir el enlace químico en compuestos y especies químicas de esta manera a través de la lente de la química organometálica se propuso en 1975, [14] poco después de la dicatión C
6(ES
3)2+
6Se observó por primera vez. [15] [16] [17]
El nombre IUPAC completo para este compuesto es 1,2,3,4,5,6-hexametilbenceno. [18] Sin embargo, los localizadores (los números delante del nombre) son superfluos, ya que el nombre hexametilbenceno identifica de forma única una sola sustancia y, por lo tanto, es el nombre IUPAC formal para el compuesto. [19] Es un compuesto aromático , con seis electrones π (que satisfacen la regla de Hückel ) deslocalizados sobre un sistema planar cíclico ; cada uno de los seis átomos de carbono del anillo tiene hibridación sp 2 y muestra una geometría planar trigonal , mientras que cada carbono de metilo es tetraédrico con hibridación sp 3 , lo que es coherente con la descripción empírica de su estructura. [1] El hexametilbenceno sólido se presenta como prismas o agujas ortorrómbicas cristalinas de incoloras a blancas [20] con un punto de fusión de 165–166 °C, [21] un punto de ebullición de 268 °C y una densidad de 1,0630 g cm −3 . [20] Es insoluble en agua, pero soluble en disolventes orgánicos, incluidos el benceno y el etanol . [20]
El hexametilbenceno a veces se denomina meliteno, [20] un nombre derivado de la melita , un raro mineral de color miel ( μέλι meli ( GEN μέλιτος melitos ) es la palabra griega para miel. [22] ) La melita se compone de una sal de aluminio hidratada del ácido bencenohexacarboxílico (ácido melítico), con fórmula Al
2[DO
6(CO
2)
6]•16H
2O . [5] El ácido melítico puede derivarse del mineral, [23] y la reducción posterior produce meliteno. Por el contrario, el meliteno puede oxidarse para formar ácido melítico: [4]

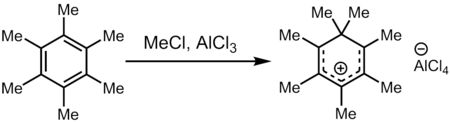
El tratamiento del hexametilbenceno con una mezcla superelectrófila de cloruro de metilo y tricloruro de aluminio (una fuente de Me δ⊕ Cl--- δ⊖ AlCl 3 ) produce el catión heptametilbenceno, uno de los primeros carbocationes que se observan directamente.
En 1927, Kathleen Lonsdale determinó la estructura sólida del hexametilbenceno a partir de cristales proporcionados por Christopher Kelk Ingold . [3] Su análisis de difracción de rayos X se publicó en Nature [24] y posteriormente se describió como "notable ... para esa fecha temprana". [3] Lonsdale describió el trabajo en su libro Crystals and X-Rays , [25] explicando que reconoció que, aunque la celda unitaria era triclínica , el patrón de difracción tenía una simetría pseudohexagonal que permitía restringir las posibilidades estructurales lo suficiente para que un enfoque de prueba y error produjera un modelo. [3] Este trabajo demostró definitivamente que el hexametilbenceno es plano y que las distancias carbono a carbono dentro del anillo son las mismas, [2] proporcionando evidencia crucial para comprender la naturaleza de la aromaticidad .
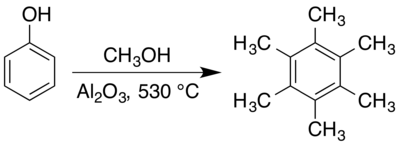
El compuesto se puede preparar haciendo reaccionar fenol con metanol a temperaturas elevadas sobre un catalizador sólido adecuado como alúmina . [26] [21] [27] El mecanismo del proceso se ha estudiado ampliamente, [28] [29] [30] [31] habiéndose identificado varios intermediarios . [27] [32] [33] La trimerización de alquino de dimetilacetileno también produce hexametilbenceno [34] en presencia de un catalizador adecuado. [35] [36]
En 1880, Joseph Achille Le Bel y William H. Greene informaron [37] lo que se ha descrito como una síntesis "extraordinaria" de hexametilbenceno a partir de metanol en un solo recipiente catalizada por cloruro de zinc . [38] En el punto de fusión del catalizador (283 °C), la reacción tiene una energía libre de Gibbs (ΔG) de −1090 kJ mol −1 y se puede idealizar como: [38]
Le Bel y Greene racionalizaron el proceso como una implicación de la aromatización por condensación de unidades de metileno , formadas por deshidratación de moléculas de metanol, seguida de una metilación completa de Friedel-Crafts del anillo de benceno resultante con clorometano generado in situ . [38] Los productos principales fueron una mezcla de hidrocarburos saturados , con hexametilbenceno como producto menor. [39] El hexametilbenceno también se produce como un producto menor en la síntesis de alquilación de Friedel-Crafts de dureno a partir de p -xileno , y se puede producir por alquilación con buen rendimiento a partir de dureno o pentametilbenceno . [40]
El hexametilbenceno se prepara típicamente en fase gaseosa a temperaturas elevadas sobre catalizadores sólidos. Un enfoque temprano para preparar hexametilbenceno implicaba hacer reaccionar una mezcla de vapores de acetona y metanol sobre un catalizador de alúmina a 400 °C. [41] La combinación de fenoles con metanol sobre alúmina en una atmósfera de dióxido de carbono seco a 410–440 °C también produce hexametilbenceno, [26] aunque como parte de una mezcla compleja de anisol (metoxibenceno), cresoles (metilfenoles) y otros fenoles metilados. [32] Una preparación de síntesis orgánica , utilizando metanol y fenol con un catalizador de alúmina a 530 °C, da aproximadamente un rendimiento del 66%, [21] aunque también se ha informado de la síntesis en diferentes condiciones. [27]
Se han investigado los mecanismos de tales reacciones mediadas por la superficie, con la intención de lograr un mayor control sobre el resultado de la reacción, [29] [42] especialmente en la búsqueda de una orto- metilación selectiva y controlada. [30] [31] [43] [44] Se ha informado que tanto el anisol [32] como el pentametilbenceno [27] son intermediarios en el proceso. Valentin Koptyug y sus colaboradores encontraron que ambos isómeros de hexametilciclohexadienona (2,3,4,4,5,6- y 2,3,4,5,6,6-) son intermediarios en el proceso, experimentando una migración de metilo para formar el esqueleto carbonado de 1,2,3,4,5,6-hexametilbenceno. [28] [33]
La trimerización de tres moléculas de 2-butino (dimetilacetileno) produce hexametilbenceno. [34] La reacción está catalizada por tri-tetrahidrofuranato de trifenilcromo [35] o por un complejo de triisobutilaluminio y tetracloruro de titanio . [36]

El hexametilbenceno se puede utilizar como ligando en compuestos organometálicos .
El hexametilbenceno no tiene usos comerciales ni generalizados. Su interés es exclusivamente para la investigación química.
Forma un aducto de color amarillo anaranjado 1:1 con cloruro de picrilo , [45] probablemente debido al apilamiento π de los sistemas aromáticos.
La oxidación con ácido trifluoroperacético o peróxido de hidrógeno produce 2,3,4,5,6,6-hexametil-2,4-ciclohexadienona: [46] [28] [33] )

También se ha utilizado como disolvente para espectroscopia RMN de 3 He . [47]
Al igual que con el propio benceno, el sistema aromático rico en electrones del hexametilbenceno le permite actuar como ligando en la química organometálica . [6] La naturaleza donadora de electrones de los grupos metilo (tanto que hay seis de ellos individualmente como que hay seis pares meta entre ellos) mejora la basicidad del anillo central de seis a siete órdenes de magnitud en relación con el benceno. [48] Se han informado ejemplos de tales complejos para una variedad de centros metálicos, incluidos cobalto, [49] cromo, [35] hierro, [7] renio, [50] rodio, [49] rutenio, [8] y titanio. [36] Los cationes conocidos de complejos sándwich de cobalto y rodio con hexametilbenceno toman la forma [M(C
6(ES
3)
6)
2] n + (M = Co, Fe, Rh, Ru; n = 1, 2), donde el centro metálico está unido por los electrones π de las dos fracciones areno , y puede sintetizarse fácilmente a partir de sales metálicas apropiadas mediante intercambio de ligando, por ejemplo: [49]
Los complejos pueden sufrir reacciones redox . Los dicationes de rodio y cobalto sufren una reducción de un electrón con un metal activo adecuado (aluminio para el sistema de cobalto, zinc para el rodio), y las ecuaciones que describen las reacciones en el sistema de cobalto son las siguientes: [49]

En el campo de la química del organorutenio , la interconversión redox de la reducción análoga de dos electrones del dicatión y su producto neutro ocurre a -1,02 V en acetonitrilo [7] y está acompañada por un cambio estructural. [8] [51] La hapticidad de uno de los ligandos de hexametilbenceno cambia con el estado de oxidación del centro de rutenio, siendo reducido el dicatión [Ru(η 6 -C 6 (CH 3 ) 6 ) 2 ] 2+ a [Ru(η 4 -C 6 (CH 3 ) 6 )(η 6 -C 6 (CH 3 ) 6 )], [8] con el cambio estructural permitiendo que cada complejo cumpla con la regla de los 18 electrones y maximice la estabilidad.
El complejo de hierro (II) equivalente sufre una reducción reversible de un electrón (a -0,48 V en etanol acuoso), pero la reducción de dos electrones (a -1,46 V) es irreversible, [7] lo que sugiere un cambio en la estructura diferente del encontrado en el sistema del rutenio.

El aislamiento de un ion con composición C
6(ES
3)
6yo+
Se informó por primera vez a partir de investigaciones sobre hexametilbenceno Dewar en la década de 1960; [52] se sugirió una estructura piramidal basada en evidencia de RMN [53] y posteriormente se respaldó con datos de estructura cristalina desordenada [9] . [54] A principios de la década de 1970, el trabajo teórico dirigido por Hepke Hogeveen predijo la existencia de una dicatión piramidal C
6(ES
3)2+
6, y la sugerencia pronto fue apoyada por evidencia experimental. [15] [16] [17] La investigación espectroscópica de la oxidación de dos electrones del benceno a temperaturas muy bajas (por debajo de 4 K) muestra que se forma un dicatión hexagonal y luego se reorganiza rápidamente en una estructura piramidal: [55]

Se esperaría que la oxidación de dos electrones del hexametilbenceno dé como resultado un reordenamiento casi idéntico a un carbocatión piramidal , pero los intentos de sintetizarlo en masa mediante este método no han tenido éxito. [9] Sin embargo, en 2016 se informó de una modificación del enfoque de Hogeveen, junto con una determinación de la estructura cristalina de alta calidad de [C
6(ES
3)
6][SbF
6]
2•HSO
3F. El núcleo piramidal tiene una altura de aproximadamente 1,18 ångströms , y cada uno de los grupos metilo del anillo está ubicado ligeramente por encima de ese plano base [9] para dar una geometría tetraédrica algo invertida para los carbonos de la base de la pirámide. El método de preparación implicó tratar el epóxido de hexametil benceno de Dewar con ácido mágico , que abstrae formalmente un anión de óxido ( O2−
) para formar la dicatión: [9]

Aunque la evidencia espectroscópica indirecta y los cálculos teóricos apuntaban previamente a su existencia, el aislamiento y la determinación estructural de una especie con un carbono hexacoordinado unido solo a otros átomos de carbono no tiene precedentes, [9] y ha atraído comentarios en Chemical & Engineering News , [11] New Scientist , [10] Science News , [12] y ZME Science. [56] El átomo de carbono en la parte superior de la pirámide se está uniendo con otros seis átomos, una disposición inusual ya que la valencia máxima habitual para este elemento es cuatro. [11] La molécula es aromática y evita exceder el octeto en el carbono al tener solo un total de seis electrones en los cinco enlaces entre la base de la pirámide y su vértice. Es decir, cada uno de los bordes verticales de la pirámide es solo un enlace parcial en lugar de un enlace covalente normal que tendría dos electrones compartidos entre dos átomos. Aunque el carbono superior se une a otros seis, lo hace utilizando un total de no más de ocho electrones. [14]
El dicatión, teniendo en cuenta los enlaces débiles que forman los bordes verticales de la pirámide, que se muestran como líneas discontinuas en la estructura, tiene un orden de enlace de Wiberg de aproximadamente 0,54; se deduce que el orden de enlace total es 5 × 0,54 + 1 = 3,7 < 4, y por lo tanto la especie no es hipervalente , aunque es hipercoordinada. [13] Las diferencias en los enlaces en el dicatión (el anillo tiene carácter aromático y los bordes verticales son enlaces parciales débiles) se reflejan en variaciones de las longitudes de enlace carbono-carbono : los enlaces del anillo son 1,439-1,445 Å, , los enlaces a los grupos metilo son 1,479-1,489 Å, , y los bordes verticales son 1,694-1,715 Å. [9] Bachrach racionalizó la aromaticidad tridimensional del dicatión al considerarlo como que comprende el anillo C
5(ES
3)+
5como donante de cuatro electrones y coronado por el CCH+
3fragmento, que proporciona dos electrones, para un total de seis electrones en la jaula aromática, de acuerdo con la regla de Hückel para n = 1. [13] Desde la perspectiva de la química organometálica, la especie puede verse como [(η5
-DO
5(ES
3)
5)C(CH
3)]
. [14] Esto satisface la regla del octeto al unir un centro de carbono (IV) ( C4+
) a un anión aromático η 5 – pentametilciclopentadienilo (donador de seis electrones) y un anión metilo (donador de dos electrones), de manera análoga a la forma en que el monómero de organocinc en fase gaseosa [(η5
-DO
5(ES
3)
5)Zn(C3H4)
3)], que tienen los mismos ligandos unidos a un centro de zinc (II) ( Zn2+
) satisface la regla de los 18 electrones en el metal. [57] [58]
Se ha comentado que "es muy importante que la gente se dé cuenta de que, aunque nos enseñan que el carbono solo puede tener cuatro amigos, el carbono puede asociarse con más de cuatro átomos" y se ha añadido que "el carbono no forma seis enlaces en el sentido en que normalmente pensamos en un enlace carbono-carbono como un enlace de dos electrones". [12] "Se trata del desafío y la posibilidad de asombrar a los químicos sobre lo que puede ser posible". [10]
{{cite book}}: |journal=ignorado ( ayuda )