La glutatión sintetasa ( GSS ) ( EC 6.3.2.3) es la segunda enzima en la vía de biosíntesis del glutatión (GSH). Cataliza la condensación de gamma-glutamilcisteína y glicina para formar glutatión. [2] La glutatión sintetasa también es un potente antioxidante. Se encuentra en muchas especies, incluidas bacterias, levaduras, mamíferos y plantas. [3]
En los seres humanos, los defectos del GSS se heredan de forma autosómica recesiva y son la causa de acidosis metabólica grave , 5-oxoprolinuria , aumento de la tasa de hemólisis y función defectuosa del sistema nervioso central . [4] Las deficiencias en GSS pueden causar un espectro de síntomas nocivos tanto en las plantas como en los seres humanos. [5]
En eucariotas , se trata de una enzima homodimérica . El dominio de unión al sustrato tiene una estructura alfa / beta /alfa de tres capas . [6] Esta enzima utiliza y estabiliza un intermedio de acilfosfato para luego realizar un ataque nucleofílico favorable de la glicina .
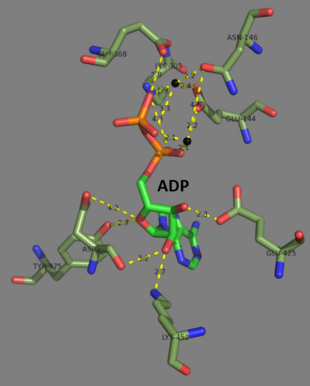
Las glutatión sintetasas humanas y de levadura son homodímeros , lo que significa que están compuestas por dos subunidades idénticas de sí mismas unidas de forma no covalente entre sí. Por otro lado, la glutatión sintetasa de E. coli es un homotetrámero . [3] Sin embargo, son parte de la superfamilia de agarre de ATP , que consta de 21 enzimas que contienen un pliegue de agarre de ATP. [7] Cada subunidad interactúa entre sí a través de interacciones de enlaces de hidrógeno de hélice alfa y hoja beta y contiene dos dominios. Un dominio facilita el mecanismo de captación de ATP [8] y el otro es el sitio activo catalítico de la γ-glutamilcisteína . El pliegue de agarre de ATP se conserva dentro de la superfamilia de agarre de ATP y se caracteriza por dos hélices alfa y láminas beta que sujetan la molécula de ATP entre ellas. [9] El dominio que contiene el sitio activo exhibe interesantes propiedades de especificidad. A diferencia de la γ-glutamilcisteína sintetasa, la glutatión sintetasa acepta una gran variedad de análogos de γ-glutamilcisteína modificados con glutamil, pero es mucho más específica para los análogos de γ-glutamilcisteína modificados con cisteína. [10] Las estructuras cristalinas han mostrado que la glutatión sintetasa se une a GSH, ADP, dos iones de magnesio y un ion sulfato. [11] Dos iones de magnesio funcionan para estabilizar el intermedio de acilfosfato, facilitar la unión de ATP y activar la eliminación del grupo fosfato del ATP. El ion sulfato sirve como reemplazo del fosfato inorgánico una vez que se forma el intermedio de acilfosfato dentro del sitio activo. [6]
A finales de 2007, se han resuelto 7 estructuras para esta clase de enzimas, con los códigos de acceso de PDB 1GLV, 1GSA, 1GSH, 1M0T, 1M0W, 2GLT y 2HGS.
La glutatión sintasa cataliza la reacción química.
Los 3 sustratos de esta enzima son ATP , gamma-L-glutamil-L-cisteína y glicina , mientras que sus 3 productos son ADP , fosfato y glutatión .
Esta enzima pertenece a la familia de las ligasas , concretamente a las que forman enlaces carbono-nitrógeno como ligasas ácido-D-aminoácido (péptidos sintasas). El nombre sistemático de esta clase de enzimas es gamma-L-glutamil-L-cisteína:glicina ligasa (formadora de ADP) . Otros nombres de uso común incluyen glutatión sintetasa y GSH sintetasa . Esta enzima participa en el metabolismo del glutamato y en el metabolismo del glutatión . Se sabe que al menos un compuesto, el fosfinato , inhibe esta enzima .
Los mecanismos biosintéticos de las sintetasas utilizan energía de los nucleósidos trifosfato , mientras que las sintasas no. [12] La glutatión sintetasa se mantiene fiel a esta regla, ya que utiliza la energía generada por el ATP. Inicialmente, el grupo carboxilato de la γ-glutamilcisteína se convierte en un acilfosfato mediante la transferencia de un grupo fosfato inorgánico de ATP para generar un intermedio de acilfosfato. Luego, el grupo amino de la glicina participa en un ataque nucleofílico, desplazando al grupo fosfato y formando GSH. [13] Una vez elaborado el producto final de GSH, la glutatión peroxidasa puede utilizarlo para neutralizar especies reactivas de oxígeno (ROS), como el H 2 O 2 o las glutatión S-transferasas en la desintoxicación de xenobióticos . [7]

La glutatión sintetasa es importante para una variedad de funciones biológicas en múltiples organismos. En Arabidopsis thaliana , los niveles bajos de glutatión sintetasa han resultado en una mayor vulnerabilidad a factores estresantes como metales pesados , sustancias químicas orgánicas tóxicas y estrés oxidativo . [15] La presencia de un grupo funcional tiol permite que su producto GSH sirva como agente oxidante y reductor eficaz en numerosos escenarios biológicos. Los tioles pueden aceptar fácilmente un par de electrones y oxidarse a disulfuros , y los disulfuros pueden reducirse fácilmente para regenerar tioles. Además, la cadena lateral tiol de las cisteínas actúa como nucleófilos potentes y reacciona con oxidantes y especies electrofílicas que de otro modo causarían daño a la célula. [16] Las interacciones con ciertos metales también estabilizan los intermediarios de tiolato. [17]
En los seres humanos, la glutatión sintetasa funciona de manera similar. Su producto GSH participa en vías celulares implicadas en la homeostasis y el mantenimiento celular. Por ejemplo, las glutatión peroxidasas catalizan la oxidación de GSH a disulfuro de glutatión (GSSG) reduciendo los radicales libres y las especies reactivas de oxígeno como el peróxido de hidrógeno. [18] La glutatión S-transferasa utiliza GSH para limpiar varios metabolitos, xenobióticos y electrófilos hasta convertirlos en mercapturados para su excreción. [19] Debido a su función antioxidante, el GSS produce principalmente GSH dentro del citoplasma de las células hepáticas y se importa a las mitocondrias donde se produce la desintoxicación. [20] El GSH también es esencial para la activación del sistema inmunológico para generar mecanismos de defensa sólidos contra patógenos invasores. [19] El GSH es capaz de prevenir la infección por el virus de la influenza. [21] [22]

Los pacientes con mutaciones en el gen GSS desarrollan deficiencia de glutatión sintetasa (GSS) , un trastorno autosómico recesivo. [23] Los pacientes desarrollan una amplia gama de síntomas dependiendo de la gravedad de las mutaciones. Los pacientes levemente afectados experimentan una anemia hemolítica compensada porque las mutaciones afectan la estabilidad de la enzima. Los individuos moderada y gravemente afectados tienen enzimas con sitios catalíticos disfuncionales, lo que les impide participar en reacciones de desintoxicación. Los síntomas fisiológicos incluyen acidosis metabólica , defectos neurológicos y mayor susceptibilidad a infecciones patógenas. [4]
El tratamiento de personas con deficiencia de glutatión sintetasa generalmente implica tratamientos terapéuticos para abordar síntomas y afecciones de leves a graves. Para tratar la acidosis metabólica , los pacientes gravemente afectados reciben grandes cantidades de bicarbonato y antioxidantes como la vitamina E y la vitamina C. [24] En casos leves, se ha demostrado que el ascorbato y la N -acetilcisteína aumentan los niveles de glutatión y aumentan la producción de eritrocitos . [25] Es importante señalar que debido a que la deficiencia de glutatión sintetasa es tan rara, no se comprende bien. La enfermedad también aparece en un espectro, por lo que es aún más difícil generalizar entre los pocos casos que se presentan. [26]