La genotipificación de SNP es la medición de las variaciones genéticas de los polimorfismos de un solo nucleótido (SNP) entre los miembros de una especie. Es una forma de genotipificación , que es la medición de la variación genética más general. Los SNP son uno de los tipos más comunes de variación genética. Un SNP es una mutación de un solo par de bases en un locus específico , que generalmente consta de dos alelos (donde la frecuencia de alelos raros es > 1%). Se ha descubierto que los SNP están involucrados en la etiología de muchas enfermedades humanas y están adquiriendo un interés particular en la farmacogenética . Debido a que los SNP se conservan durante la evolución, se han propuesto como marcadores para su uso en el análisis de loci de rasgos cuantitativos ( QTL ) y en estudios de asociación en lugar de microsatélites . El uso de SNP se está ampliando en el proyecto HapMap , que tiene como objetivo proporcionar el conjunto mínimo de SNP necesarios para genotipar el genoma humano. Los SNP también pueden proporcionar una huella genética para su uso en pruebas de identidad. [1] El aumento del interés en los SNP se ha reflejado en el rápido desarrollo de una amplia gama de métodos de genotipificación de SNP.
Se han desarrollado varias aplicaciones que interrogan a los SNP mediante la hibridación de sondas de ADN complementarias al sitio del SNP. El desafío de este enfoque es reducir la hibridación cruzada entre las sondas específicas de alelos. Este desafío generalmente se supera manipulando las condiciones de rigurosidad de la hibridación. [1]
La genotipificación por hibridación dinámica de alelos específicos (DASH) aprovecha las diferencias en la temperatura de fusión del ADN que resultan de la inestabilidad de los pares de bases no coincidentes. El proceso puede automatizarse en gran medida y comprende algunos principios simples. [ cita requerida ]
En el primer paso, se amplifica un segmento genómico y se une a una perla mediante una reacción de PCR con un cebador biotinilado. En el segundo paso, el producto amplificado se une a una columna de estreptavidina y se lava con NaOH para eliminar la cadena no biotinilada. A continuación, se añade un oligonucleótido específico del alelo en presencia de una molécula que emite fluorescencia cuando se une al ADN bicatenario. A continuación, se mide la intensidad a medida que aumenta la temperatura hasta que se puede determinar la temperatura de fusión (Tm) . Un SNP dará como resultado una Tm inferior a la esperada. [2]
Dado que la genotipificación DASH mide un cambio cuantificable en Tm, es capaz de medir todo tipo de mutaciones, no solo SNP. Otros beneficios de DASH incluyen su capacidad para trabajar con sondas sin marcadores y su diseño simple y condiciones de rendimiento. [ cita requerida ]
La detección de SNP mediante balizas moleculares utiliza una sonda de oligonucleótido monocatenario diseñada específicamente. El oligonucleótido está diseñado de tal manera que hay regiones complementarias en cada extremo y una secuencia de sonda ubicada entre ellos. Este diseño permite que la sonda adopte una estructura de horquilla o de tallo-bucle en su estado natural y aislado. Un fluoróforo está unido a un extremo de la sonda y un inhibidor de fluorescencia en el otro extremo. Debido a la estructura de tallo-bucle de la sonda, el fluoróforo está cerca del inhibidor, lo que evita que la molécula emita fluorescencia. La molécula también está diseñada de tal manera que solo la secuencia de la sonda es complementaria al ADN genómico que se utilizará en el ensayo (Abrazaya et al. 2003).
Si la secuencia de la sonda de la baliza molecular encuentra su ADN genómico objetivo durante el ensayo, se hibridará y se apareará. Debido a la longitud de la secuencia de la sonda, el segmento de horquilla de la sonda se desnaturalizará a favor de la formación de un híbrido sonda-objetivo más largo y estable. Este cambio conformacional permite que el fluoróforo y el extintor se liberen de su estrecha proximidad debido a la asociación de la horquilla, lo que permite que la molécula emita fluorescencia.
Por otro lado, si la secuencia de la sonda encuentra una secuencia objetivo con tan sólo un nucleótido no complementario, la baliza molecular permanecerá preferentemente en su estado de horquilla natural y no se observará fluorescencia, ya que el fluoróforo permanece extinguido.
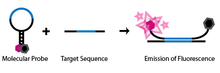
El diseño único de estas balizas moleculares permite un ensayo de diagnóstico simple para identificar SNP en una ubicación determinada. Si una baliza molecular está diseñada para coincidir con un alelo de tipo salvaje y otra para coincidir con un mutante del alelo, las dos se pueden utilizar para identificar el genotipo de un individuo. Si solo se detecta la longitud de onda del fluoróforo de la primera sonda durante el ensayo, entonces el individuo es homocigoto para el tipo salvaje. Si solo se detecta la longitud de onda de la segunda sonda, entonces el individuo es homocigoto para el alelo mutante. Finalmente, si se detectan ambas longitudes de onda, entonces ambas balizas moleculares deben estar hibridando con sus complementos y, por lo tanto, el individuo debe contener ambos alelos y ser heterocigoto.
En los arreglos de SNP de oligonucleótidos de alta densidad , cientos de miles de sondas se disponen en un pequeño chip, lo que permite interrogar muchos SNP simultáneamente. [1] Debido a que los alelos de SNP solo difieren en un nucleótido y debido a que es difícil lograr condiciones de hibridación óptimas para todas las sondas en el arreglo, el ADN objetivo tiene el potencial de hibridarse con sondas no coincidentes. Esto se soluciona en cierta medida utilizando varias sondas redundantes para interrogar cada SNP. Las sondas están diseñadas para tener el sitio SNP en varias ubicaciones diferentes, así como para contener desajustes con el alelo SNP. Al comparar la cantidad diferencial de hibridación del ADN objetivo con cada una de estas sondas redundantes, es posible determinar alelos homocigotos y heterocigotos específicos. [1] Aunque los microarreglos de oligonucleótidos tienen una especificidad y sensibilidad comparativamente menores, la escala de SNP que se pueden interrogar es un beneficio importante. El GeneChip Affymetrix Human SNP 5.0 realiza un ensayo de todo el genoma que puede genotipar más de 500.000 SNP humanos (Affymetrix 2007).
Se ha empleado una amplia gama de enzimas, incluidas la ADN ligasa , la ADN polimerasa y las nucleasas, para generar métodos de genotipificación de SNP de alta fidelidad.
El polimorfismo de longitud de fragmentos de restricción (RFLP) se considera el método más simple y temprano para detectar SNP. El SNP-RFLP hace uso de las diferentes endonucleasas de restricción y su alta afinidad por sitios de restricción únicos y específicos. Al realizar una digestión en una muestra genómica y determinar las longitudes de los fragmentos mediante un ensayo en gel, es posible determinar si las enzimas cortan o no los sitios de restricción esperados. Si no se corta la muestra genómica, se obtiene un fragmento identificablemente más grande de lo esperado, lo que implica que hay una mutación en el punto del sitio de restricción que lo protege de la actividad de la nucleasa.
Los factores combinados de la alta complejidad de la mayoría de los genomas eucariotas, el requisito de endonucleasas específicas, el hecho de que la mutación exacta no necesariamente puede resolverse en un solo experimento y la naturaleza lenta de los ensayos en gel hacen que el RFLP sea una mala opción para el análisis de alto rendimiento.
El sistema de amplificación por PCR de mutación refractaria con tetra-cebador, o ARMS-PCR, emplea dos pares de cebadores para amplificar dos alelos en una reacción de PCR. Los cebadores están diseñados de tal manera que los dos pares de cebadores se superponen en una ubicación de SNP pero cada uno coincide perfectamente con solo uno de los SNP posibles. La base de la invención es que inesperadamente, los oligonucleótidos con un residuo 3' no coincidente no funcionarán como cebadores en la PCR en condiciones apropiadas. [3] Como resultado, si un alelo dado está presente en la reacción de PCR, el par de cebadores específico para ese alelo producirá producto pero no para el alelo alternativo con un SNP diferente. Los dos pares de cebadores también están diseñados de tal manera que sus productos de PCR sean de una longitud significativamente diferente, lo que permite bandas fácilmente distinguibles por electroforesis en gel o análisis de temperatura de fusión. [4] [5] Al examinar los resultados, si una muestra genómica es homocigótica, los productos de PCR resultantes serán del cebador que coincida con la ubicación del SNP y del cebador de la cadena opuesta externa, así como de los dos cebadores externos. Si la muestra genómica es heterocigótica, los productos resultarán del cebador de cada alelo y sus respectivas contrapartes del cebador externo, así como de los cebadores externos.
Una estrategia alternativa es realizar múltiples reacciones de qPCR con diferentes conjuntos de cebadores que se dirigen a cada alelo por separado. Los cebadores bien diseñados amplificarán su SNP objetivo en un ciclo mucho más temprano que los otros SNP. Esto permite distinguir más de dos alelos, aunque se requiere una reacción de qPCR individual para cada SNP. Para lograr una especificidad lo suficientemente alta, la secuencia del cebador puede requerir la colocación de un desajuste artificial cerca de su extremo 3', que es un enfoque generalmente conocido como Taq-MAMA. [6]

La endonucleasa Flap (FEN) es una endonucleasa que cataliza la escisión específica de la estructura. Esta escisión es muy sensible a los desajustes y se puede utilizar para interrogar a los SNP con un alto grado de especificidad [7].
En el ensayo básico Invader, una FEN llamada cleavasa se combina con dos sondas de oligonucleótidos específicos, que junto con el ADN objetivo, pueden formar una estructura tripartita reconocida por la cleavasa. [7] La primera sonda, llamada oligonucleótido Invader , es complementaria al extremo 3' del ADN objetivo. La última base del oligonucleótido Invader es una base no coincidente que se superpone al nucleótido SNP en el ADN objetivo. La segunda sonda es una sonda específica de alelo que es complementaria al extremo 5' del ADN objetivo, pero también se extiende más allá del lado 3' del nucleótido SNP. La sonda específica de alelo contendrá una base complementaria al nucleótido SNP. Si el ADN objetivo contiene el alelo deseado, las sondas Invader y específicas de alelo se unirán al ADN objetivo formando la estructura tripartita. Esta estructura es reconocida por la cleavasa, que escindirá y liberará el extremo 3' de la sonda específica de alelo. Si el nucleótido SNP en el ADN objetivo no es complementario a la sonda específica del alelo, no se forma la estructura tripartita correcta y no se produce la escisión. El ensayo Invader suele combinarse con un sistema de transferencia de energía por resonancia de fluorescencia (FRET) para detectar el evento de escisión. En esta configuración, una molécula extintora se une al extremo 3' y un fluoróforo se une al extremo 5' de la sonda específica del alelo. Si se produce la escisión, el fluoróforo se separará de la molécula extintora, lo que generará una señal detectable. [7]
Solo se produce una escisión mínima con sondas no coincidentes, lo que hace que el ensayo Invader sea altamente específico. Sin embargo, en su formato original, solo se podía interrogar un alelo de SNP por muestra de reacción y se requería una gran cantidad de ADN objetivo para generar una señal detectable en un período de tiempo razonable. [7] Varios desarrollos han ampliado el ensayo Invader original . Al llevar a cabo reacciones de escisión FEN secundarias, la Reacción de Amplificación de Señal Invasiva en Serie (SISAR) permite interrogar ambos alelos de SNP en una sola reacción. El ensayo SISAR Invader también requiere menos ADN objetivo, lo que mejora la sensibilidad del ensayo Invader original. [7] El ensayo también se ha adaptado de varias maneras para su uso en un formato de alto rendimiento. En una plataforma, las sondas específicas de alelos están ancladas a microesferas. Cuando la escisión por FEN genera una señal fluorescente detectable, la señal se mide utilizando citometría de flujo. La sensibilidad de la citometría de flujo elimina la necesidad de amplificar el ADN objetivo mediante PCR (Rao et al. 2003). Estas plataformas de alto rendimiento no han avanzado más allá de la etapa de prueba de concepto y hasta ahora el sistema Invader no se ha utilizado en ningún proyecto de genotipado de SNP a gran escala. [7]
La extensión del cebador es un proceso de dos pasos que primero implica la hibridación de una sonda con las bases inmediatamente anteriores al nucleótido SNP, seguida de una reacción de "minisecuenciación", en la que la ADN polimerasa extiende el cebador hibridado añadiendo una base que es complementaria al nucleótido SNP. Esta base incorporada se detecta y determina el alelo SNP (Goelet et al. 1999; Syvanen 2001). Debido a que la extensión del cebador se basa en la enzima ADN polimerasa de alta precisión, el método es generalmente muy confiable. La extensión del cebador puede genotipar la mayoría de los SNP en condiciones de reacción muy similares, lo que también lo hace muy flexible. El método de extensión del cebador se utiliza en varios formatos de ensayo. Estos formatos utilizan una amplia gama de técnicas de detección que incluyen la espectrometría de masas MALDI-TOF (ver Sequenom ) y métodos similares a ELISA . [1]
En general, existen dos enfoques principales que utilizan la incorporación de didesoxinucleótidos marcados con fluorescencia (ddNTP) o desoxinucleótidos marcados con fluorescencia (dNTP). Con los ddNTP, las sondas se hibridan con el ADN diana inmediatamente aguas arriba del nucleótido SNP, y se añade un único ddNTP complementario al alelo SNP al extremo 3' de la sonda (el 3'-hidroxilo faltante en el didioxinucleótido impide que se añadan más nucleótidos). Cada ddNTP se marca con una señal fluorescente diferente, lo que permite la detección de los cuatro alelos en la misma reacción. Con los dNTP, las sondas específicas de alelos tienen bases 3' que son complementarias a cada uno de los alelos SNP que se están interrogando. Si el ADN diana contiene un alelo complementario a la base 3' de la sonda, el ADN diana se hibridará completamente con la sonda, lo que permitirá que la ADN polimerasa se extienda desde el extremo 3' de la sonda. Esto se detecta mediante la incorporación de los dNTP marcados con fluorescencia en el extremo de la sonda. Si el ADN diana no contiene un alelo complementario a la base 3' de la sonda, el ADN diana producirá un desajuste en el extremo 3' de la sonda y la ADN polimerasa no podrá extenderse desde el extremo 3' de la sonda. El beneficio del segundo enfoque es que varios dNTP marcados pueden incorporarse a la hebra en crecimiento, lo que permite un aumento de la señal. Sin embargo, en algunos casos raros, la ADN polimerasa puede extenderse desde sondas 3' no coincidentes, lo que da un resultado positivo falso. [1]
El método de genotipado de SNP iPLEX de Sequenom utiliza un espectrómetro de masas MassARRAY. Las sondas de extensión están diseñadas de tal manera que se pueden amplificar y analizar 40 ensayos de SNP diferentes en un cóctel de PCR. La reacción de extensión utiliza ddNTP como se indicó anteriormente, pero la detección del alelo de SNP depende de la masa real del producto de extensión y no de una molécula fluorescente. Este método es para un rendimiento bajo a medio alto y no está destinado al escaneo del genoma completo.
La flexibilidad y especificidad de la extensión de cebadores la hacen apta para análisis de alto rendimiento. Las sondas de extensión de cebadores se pueden disponer en portaobjetos, lo que permite genotipar muchos SNP a la vez. Esta tecnología, conocida en términos generales como extensión de cebadores en matriz (APEX), tiene varias ventajas sobre los métodos basados en la hibridación diferencial de sondas. Comparativamente, los métodos APEX tienen un mayor poder de discriminación que los métodos que utilizan esta hibridación diferencial, ya que a menudo es imposible obtener las condiciones de hibridación óptimas para las miles de sondas en microarreglos de ADN (normalmente esto se soluciona con sondas altamente redundantes). Sin embargo, no se puede lograr la misma densidad de sondas en los métodos APEX, lo que se traduce en un menor rendimiento por ejecución. [1]
El ensayo Infinium de Illumina Incorporated es un ejemplo de un proceso de genotipado de todo el genoma que se basa en el método de extensión de cebadores. En el ensayo Infinium, se pueden genotipificar más de 100.000 SNP. El ensayo utiliza nucleótidos marcados con hapteno en una reacción de extensión de cebadores. La etiqueta de hapteno es reconocida por anticuerpos, que a su vez se acoplan a una señal detectable (Gunderson et al. 2006).
APEX-2 es un método de genotipado de extensión de cebadores en matriz que puede identificar cientos de SNP o mutaciones en paralelo mediante PCR multiplex homogénea eficiente (hasta 640 plex) y extensión de una sola base de cuatro colores en una micromatriz. La PCR multiplex requiere dos oligonucleótidos por SNP/mutación que genere amplicones que contengan el par de bases probado. Los mismos oligonucleótidos se utilizan en el siguiente paso como cebadores de extensión de una sola base inmovilizados en una micromatriz (Krjutskov et al. 2008).
La actividad nucleasa 5' de la ADN polimerasa Taq se utiliza en el ensayo TaqMan para la genotipificación de SNP. El ensayo TaqMan se realiza simultáneamente con una reacción de PCR y los resultados se pueden leer en tiempo real a medida que avanza la reacción de PCR (McGuigan y Ralston 2002). El ensayo requiere cebadores de PCR directa e inversa que amplificarán una región que incluye el sitio polimórfico de SNP. La discriminación de alelos se logra utilizando FRET combinado con una o dos sondas específicas de alelo que se hibridan con el sitio polimórfico de SNP. Las sondas tendrán un fluoróforo unido a su extremo 5' y una molécula extintora unida a su extremo 3'. Mientras la sonda esté intacta, el extintor permanecerá muy cerca del fluoróforo, eliminando la señal del fluoróforo. Durante el paso de amplificación por PCR, si la sonda específica del alelo es perfectamente complementaria al alelo SNP, se unirá a la cadena de ADN diana y luego será degradada por la actividad 5'-nucleasa de la polimerasa Taq a medida que extiende el ADN desde los cebadores de PCR. La degradación de la sonda da como resultado la separación del fluoróforo de la molécula extintora, lo que genera una señal detectable. Si la sonda específica del alelo no es perfectamente complementaria, tendrá una temperatura de fusión más baja y no se unirá de manera tan eficiente. Esto evita que la nucleasa actúe sobre la sonda (McGuigan y Ralston 2002).
Dado que el ensayo TaqMan se basa en PCR, es relativamente sencillo de implementar. El ensayo TaqMan se puede multiplexar combinando la detección de hasta siete SNP en una reacción. Sin embargo, dado que cada SNP requiere una sonda distinta, el ensayo TaqMan está limitado por la proximidad a la que se pueden situar los SNP. La escala del ensayo se puede aumentar drásticamente realizando muchas reacciones simultáneas en placas de microtitulación. En general, TaqMan se limita a aplicaciones que implican interrogar a un pequeño número de SNP, ya que se deben diseñar sondas y condiciones de reacción óptimas para cada SNP (Syvanen 2001).
La ADN ligasa cataliza la ligación del extremo 3' de un fragmento de ADN al extremo 5' de un fragmento de ADN directamente adyacente. Este mecanismo se puede utilizar para interrogar a un SNP hibridando dos sondas directamente sobre el sitio polimórfico del SNP, por lo que la ligación puede ocurrir si las sondas son idénticas al ADN objetivo. En el ensayo de la ligasa de oligonucleótidos, se diseñan dos sondas: una sonda específica del alelo que se hibrida con el ADN objetivo de modo que su base 3' esté situada directamente sobre el nucleótido del SNP y una segunda sonda que hibrida la plantilla aguas arriba (aguas abajo en la cadena complementaria) del sitio polimórfico del SNP proporcionando un extremo 5' para la reacción de ligación. Si la sonda específica del alelo coincide con el ADN objetivo, se hibridará completamente con el ADN objetivo y puede ocurrir la ligación. La ligación no ocurre generalmente en presencia de una base 3' no coincidente. Los productos ligados o no ligados se pueden detectar mediante electroforesis en gel, espectrometría de masas MALDI-TOF o mediante electroforesis capilar para aplicaciones a gran escala. [1] Con secuencias y etiquetas apropiadas en los oligonucleótidos, se pueden generar datos de secuencia de alto rendimiento a partir de los productos ligados y determinar los genotipos (Curry et al., 2012). El uso de una gran cantidad de índices de muestra permite generar datos de secuencia de alto rendimiento sobre cientos de SNP en miles de muestras en una pequeña parte de una ejecución de secuenciación de alto rendimiento. Esta es una tecnología de genotipado masivo por secuenciación (MGST). [ cita requerida ]
Las propiedades características del ADN, como la temperatura de fusión y la conformación monocatenaria, se han utilizado en varias aplicaciones para distinguir alelos de SNP. Estos métodos suelen lograr una alta especificidad, pero requieren condiciones altamente optimizadas para obtener los mejores resultados posibles.
El ADN monocatenario (ssDNA) se pliega en una estructura terciaria. La conformación depende de la secuencia y la mayoría de las mutaciones de un solo par de bases alterarán la forma de la estructura. Cuando se aplica a un gel, la forma terciaria determinará la movilidad del ssDNA, lo que proporciona un mecanismo para diferenciar entre los alelos de SNP. Este método implica primero la amplificación por PCR del ADN objetivo. Los productos de PCR de doble cadena se desnaturalizan utilizando calor y formaldehído para producir ssDNA. El ssDNA se aplica a un gel de electroforesis no desnaturalizante y se deja plegar en una estructura terciaria. Las diferencias en la secuencia de ADN alterarán la conformación terciaria y se detectarán como una diferencia en la movilidad de la cadena de ssDNA (Costabile et al. 2006). Este método se utiliza ampliamente porque es técnicamente simple, relativamente económico y utiliza equipo comúnmente disponible. Sin embargo, en comparación con otros métodos de genotipado de SNP, la sensibilidad de este ensayo es menor. Se ha descubierto que la conformación del ssADN depende en gran medida de la temperatura y, por lo general, no resulta evidente cuál es la temperatura ideal. Muy a menudo, el ensayo se llevará a cabo utilizando varias temperaturas diferentes. También existe una restricción en la longitud del fragmento porque la sensibilidad disminuye cuando se utilizan secuencias de más de 400 pb (Costabile et al. 2006).

El método de electroforesis en gel con gradiente de temperatura (TGGE) o electroforesis capilar con gradiente de temperatura (TGCE) se basa en el principio de que el ADN parcialmente desnaturalizado está más restringido y viaja más lentamente en un material poroso como un gel. Esta propiedad permite la separación del ADN por temperatura de fusión. Para adaptar estos métodos para la detección de SNP, se utilizan dos fragmentos: el ADN objetivo que contiene el sitio polimórfico de SNP que se está interrogando y una secuencia de ADN específica del alelo, denominada fragmento de ADN normal. El fragmento normal es idéntico al ADN objetivo excepto potencialmente en el sitio polimórfico de SNP, que es desconocido en el ADN objetivo. Los fragmentos se desnaturalizan y luego se vuelven a hibridar. Si el ADN objetivo tiene el mismo alelo que el fragmento normal, se formarán homodúplex que tendrán la misma temperatura de fusión. Cuando se ejecuta en el gel con un gradiente de temperatura, solo aparecerá una banda. Si el ADN objetivo tiene un alelo distinto, se formarán cuatro productos después del paso de rehibridación; homodúplex que consisten en ADN diana, homodúplex que consisten en ADN normal y dos heterodúplex de cada cadena de ADN diana hibridados con la cadena de ADN normal. Estos cuatro productos tendrán distintas temperaturas de fusión y aparecerán como cuatro bandas en el gel desnaturalizante. [1]
La cromatografía líquida desnaturalizante de alto rendimiento (DHPLC) utiliza HPLC de fase inversa para interrogar a los SNP. La clave de la DHPLC es la fase sólida, que tiene una afinidad diferencial por el ADN monocatenario y bicatenario. En la DHPLC, los fragmentos de ADN se desnaturalizan mediante calor y luego se dejan que se vuelvan a hibridar. La temperatura de fusión de los fragmentos de ADN rehibridados determina el tiempo que se conservan en la columna. [8] Mediante PCR, se generan dos fragmentos: el ADN objetivo que contiene el sitio polimórfico del SNP y una secuencia de ADN específica del alelo, denominada fragmento de ADN normal. Este fragmento normal es idéntico al ADN objetivo excepto potencialmente en el sitio polimórfico del SNP, que es desconocido en el ADN objetivo. Los fragmentos se desnaturalizan y luego se dejan que se vuelvan a hibridar gradualmente. Los productos rehibridados se agregan a la columna de DHPLC. Si el alelo del SNP en el ADN objetivo coincide con el fragmento de ADN normal, solo se formarán homodúplex idénticos durante el paso de rehibridación. Si el ADN diana contiene un alelo SNP diferente al del fragmento de ADN normal, se formarán heterodúplex del ADN diana y del ADN normal que contienen un sitio polimórfico no coincidente, además de homodúplex. Los heterodúplex no coincidentes tendrán una temperatura de fusión diferente a la de los homodúplex y no se conservarán en la columna durante tanto tiempo. Esto genera un patrón cromatográfico que es distinto del patrón que se generaría si el fragmento de ADN diana y los fragmentos de ADN normal fueran idénticos. El ADN eluido se detecta mediante absorción UV. [8]
La DHPLC se automatiza fácilmente, ya que no necesita etiquetar ni purificar los fragmentos de ADN. El método también es relativamente rápido y tiene una alta especificidad. Una desventaja importante de la DHPLC es que la temperatura de la columna debe optimizarse para cada objetivo a fin de lograr el grado correcto de desnaturalización. [1]
El análisis de fusión de alta resolución es el método basado en PCR más sencillo de entender. Básicamente, las mismas propiedades termodinámicas que permitieron que las técnicas de gel funcionaran aquí se aplican, y en tiempo real. Un fluorímetro monitorea la desnaturalización post-PCR de todo el amplicón dsDNA. Se crean cebadores específicos para el sitio que se desea amplificar. Se "pinta" el amplicón con un tinte específico de doble cadena, incluido en la mezcla de PCR. El tinte específico de ds se integra en el producto de PCR. En esencia, todo el amplicón se convierte en una sonda. Esto abre nuevas posibilidades para el descubrimiento. O bien se colocan los cebadores muy cerca de cada lado del SNP en cuestión (genotipado de amplicones pequeños, Liew, 2004) o se amplifica una región más grande (100-400 pb de longitud) para fines de escaneo. Para el genotipado simple de un SNP, es más fácil simplemente hacer que el amplicón sea pequeño para minimizar las posibilidades de confundir un SNP con otro. Se determina la temperatura de fusión (Tm) de todo el amplicón y la mayoría de los homocigotos son suficientemente diferentes (en los mejores instrumentos) en Tm para determinar el genotipo. Los heterocigotos son incluso más fáciles de diferenciar porque tienen heterodúplex generados (consulte las explicaciones basadas en gel) que amplían la transición de fusión y generalmente dan dos picos discernibles. Se ha descrito la fusión de amplicones utilizando un cebador marcado con fluorescencia (Gundry et al., 2003), pero es menos práctico que usar colorantes específicos de ds debido al costo del cebador fluorogénico.
El escaneo de amplicones más grandes se basa en los mismos principios que se describen anteriormente. Sin embargo, la temperatura de fusión y la forma general de la curva de fusión se vuelven informativas. Para amplicones >c.150bp, a menudo hay >2 picos de fusión, cada uno de los cuales puede variar, dependiendo de la composición de la plantilla de ADN. Numerosos investigadores han podido eliminar con éxito la mayoría de su secuenciación a través del escaneo basado en fusión, lo que permite una genotipificación precisa basada en locus de una gran cantidad de individuos. [9] Muchos investigadores han descubierto que el escaneo de mutaciones utilizando fusión de alta resolución es una forma viable y práctica de estudiar genes completos.
Las proteínas que se unen a los desajustes de ADN pueden distinguir desajustes de nucleótidos individuales y, por lo tanto, facilitar el análisis diferencial de los SNP. Por ejemplo, la proteína MutS de Thermus aquaticus se une a diferentes desajustes de nucleótidos individuales con diferentes afinidades y se puede utilizar en la electroforesis capilar para diferenciar los seis conjuntos de desajustes (Drabovich y Krylov, 2006).
SNPlex es una plataforma de genotipificación patentada vendida por Applied Biosystems .
La nucleasa Surveyor es una enzima endonucleasa de desajuste que reconoce todas las sustituciones de bases y pequeñas inserciones/deleciones (indels), y corta el lado 3′ de los sitios desajustes en ambas cadenas de ADN.
Las tecnologías de secuenciación de última generación, como la pirosecuenciación, secuencian menos de 250 bases en una lectura, lo que limita su capacidad para secuenciar genomas completos. Sin embargo, su capacidad para generar resultados en tiempo real y su potencial para ampliarse a gran escala las convierte en una opción viable para secuenciar regiones pequeñas y realizar la genotipificación de SNP. En comparación con otros métodos de genotipificación de SNP, la secuenciación es particularmente adecuada para identificar múltiples SNP en una región pequeña, como la región altamente polimórfica del complejo mayor de histocompatibilidad del genoma. [1]