El cloruro de zinc es un compuesto químico inorgánico de fórmula ZnCl 2 · n H 2 O, con n que varía de 0 a 4,5, formando hidratos . El cloruro de zinc anhidro y sus hidratos son sólidos cristalinos incoloros o blancos y muy solubles en agua . Se conocen cinco hidratos de cloruro de zinc, así como cuatro formas de cloruro de zinc anhidro. [5] Todas las formas de cloruro de zinc son delicuescentes . El cloruro de zinc encuentra una amplia aplicación en el procesamiento textil , fundentes metalúrgicos y síntesis química.
Se conocen cuatro formas cristalinas ( polimorfos ) de ZnCl 2 : α, β, γ y δ. Cada caso presenta centros tetraédricos de Zn 2+ . [6]
Aquí a , b y c son constantes de red, Z es el número de unidades estructurales por celda unitaria y ρ es la densidad calculada a partir de los parámetros de la estructura. [7] [8] [9]
La forma ortorrómbica (δ) cambia rápidamente a una de las otras formas al exponerse a la atmósfera. Una posible explicación es que los iones OH − que se originan en el agua absorbida facilitan la reordenación. [6] El enfriamiento rápido del ZnCl 2 fundido da un vidrio . [10]
El ZnCl 2 fundido tiene una alta viscosidad en su punto de fusión y una conductividad eléctrica comparativamente baja, que aumenta notablemente con la temperatura. [11] [12] Como lo indica un estudio de dispersión Raman , la viscosidad se explica por la presencia de polímeros, [13] . El estudio de dispersión de neutrones indicó la presencia de centros tetraédricos de ZnCl 4 , lo que requiere también la agregación de monómeros de ZnCl 2 . [14]
Se conocen varios hidratos de cloruro de zinc: ZnCl 2 (H 2 O) n con n = 1, 1,33, 2,5, 3 y 4,5. [15] Sin embargo, sólo se ha dilucidado estructuralmente el 1,33-hidrato, el hemipentahidrato, el trihidrato y el heminonahidrato.
El 1,33-hidrato, que antes se pensaba que era el hemitrihidrato, consta de centros trans -Zn(H 2 O) 4 Cl 2 con los átomos de cloro conectados a cadenas repetidas de ZnCl 4 . El hemipentahidrato, formulado estructuralmente [Zn(H 2 O) 5 ][ZnCl 4 ], consiste en octaedros de Zn(H 2 O) 5 Cl donde el átomo de cloro es parte de un [ZnCl 4 ] 2- tetraedro. El trihidrato consta de cationes distintos de hexaaquozinc (II) y aniones de tetraclorozincato ; formulado [Zn(H 2 O) 6 ][ZnCl 4 ]. Finalmente, el heminonahidrato, formulado estructuralmente [Zn(H 2 O) 6 ][ZnCl 4 ]·3H 2 O, también consta de distintos cationes hexaaquozinc(II) y aniones tetraclorocincato como el trihidrato, pero tiene tres moléculas de agua adicionales. [16] [17]
El ZnCl 2 anhidro se puede preparar a partir de zinc y cloruro de hidrógeno gaseoso a 700 °C: [5]
Las soluciones acuosas se pueden preparar fácilmente de manera similar tratando Zn metálico, carbonato de zinc, óxido de zinc y sulfuro de zinc con ácido clorhídrico: [18]
Los hidratos se pueden producir mediante la evaporación de una solución acuosa de cloruro de zinc. Diferentes temperaturas de evaporación producen diferentes hidratos; por ejemplo, la evaporación a temperatura ambiente produce el 1,33-hidrato. [16] [19] Las temperaturas de evaporación más bajas producen hidratos más altos. [17]
Las muestras comerciales de cloruro de zinc suelen contener agua y productos de la hidrólisis como impurezas. Estas muestras pueden purificarse mediante recristalización en dioxano caliente . Las muestras anhidras se pueden purificar mediante sublimación en una corriente de gas cloruro de hidrógeno , seguido de calentamiento del sublimado a 400 °C en una corriente de gas nitrógeno seco . [20] Finalmente, el método más simple se basa en tratar el cloruro de zinc con cloruro de tionilo . [21]
El ZnCl 2 anhidro fundido a 500–700 °C disuelve el zinc metálico y, al enfriar rápidamente la masa fundida, se forma un vidrio diamagnético amarillo que, según los estudios Raman, contiene Zn.2+2ion. [15]
Se conocen varias sales que contienen el anión tetraclorozincato , [ZnCl 4 ] 2− . [11] El "reactivo de Caulton", V 2 Cl 3 ( thf ) 6 ] [Zn 2 Cl 6 ] , que se utiliza en química orgánica, es un ejemplo de una sal que contiene [Zn 2 Cl 6 ] 2− . [22] [23] El compuesto Cs 3 ZnCl 5 contiene aniones tetraédricos [ZnCl 4 ] 2− y Cl − , [6] por lo que el compuesto no es pentaclorozincato de cesio, sino cloruro de tetraclorozincato de cesio. No se han caracterizado compuestos que contengan el ion [ZnCl 6 ] 4- (ion hexaclorocincato). [6]
El compuesto ZnCl 2 ·0,5HCl·H 2 O puede prepararse mediante precipitación cuidadosa a partir de una solución de ZnCl 2 acidificada con HCl. Contiene un anión polimérico (Zn 2 Cl−5) n con equilibrio de iones hidronio monohidratados , H 5 O+2iones. [6] [24]
El complejo de coordinación ZnCl 2 (NH 2 OH) 2 (dicloruro de zinc di(hidroxilamina)), conocido como sal de Crismer, libera hidroxilamina al calentarse. [25]
El cloruro de zinc se disuelve fácilmente en agua para dar especies ZnCl x (H 2 O) 4- x y algo de cloruro libre. [26] [27] [28] Las soluciones acuosas de ZnCl 2 son ácidas: una solución acuosa 6 M tiene un pH de 1. [15] La acidez de las soluciones acuosas de ZnCl 2 en relación con las soluciones de otras sales de Zn 2+ (digamos el sulfato) se debe a la formación de complejos tetraédricos de cloro agua donde la reducción del número de coordinación de 6 a 4 reduce aún más la fuerza de los enlaces O-H en las moléculas de agua solvatadas. [29]
En una solución alcalina, el cloruro de zinc se convierte en varios hidroxicloruros de zinc. Estos incluyen [Zn(OH) 3Cl ] 2− , [ Zn( OH) 2Cl2 ] 2− , [Zn(OH)Cl3 ] 2− y el insoluble Zn5 ( OH ) 8Cl2 · H2 . O. Este último es el mineral simonkolleita . [30] Cuando se calientan hidratos de cloruro de zinc, se desprende gas HCl y se producen hidroxicloruros. [31]
Cuando se tratan soluciones de cloruro de zinc con amoníaco , se producen varios complejos de aminas . Estos incluyen Zn(NH 3 ) 4 Cl 2 ·H 2 O y en concentración ZnCl 2 (NH 3 ) 2 . [32] El primero contiene el ion [Zn(NH 3 ) 6 ] 2+ , [6] y el segundo es molecular con una geometría tetraédrica distorsionada. [33] Las especies en solución acuosa han sido investigadas y muestran que [Zn(NH 3 ) 4 ] 2+ es la principal especie presente con [Zn(NH 3 ) 3 Cl] + también presente en una proporción más baja de NH 3 :Zn. [34]
El cloruro de zinc acuoso reacciona con el óxido de zinc para formar un cemento amorfo que fue investigado por primera vez en 1855 por Stanislas Sorel . Más tarde, Sorel investigó el cemento de oxicloruro de magnesio relacionado , que lleva su nombre. [35]
El cloruro de zinc anhidro puede fundirse y hervir sin descomposición hasta 900 °C en una atmósfera inerte. Sin embargo, en presencia de oxígeno, el cloruro de zinc se oxida a óxido de zinc por encima de 400 °C. [36]
Cuando se calienta cloruro de zinc hidratado, se produce Zn(OH)Cl en lugar de cloruro de zinc anhidro: [37]
La celulosa se disuelve en soluciones acuosas de ZnCl 2 y se han detectado complejos de zinc-celulosa. [38] La celulosa también se disuelve en hidrato de ZnCl 2 fundido y se realizan carboxilación y acetilación en el polímero de celulosa. [39]
Así, aunque muchas sales de zinc tienen diferentes fórmulas y diferentes estructuras cristalinas , estas sales se comportan de manera muy similar en solución acuosa. Por ejemplo, las soluciones preparadas a partir de cualquiera de los polimorfos de ZnCl 2 , así como otros haluros (bromuro, yoduro) y el sulfato a menudo se pueden usar indistintamente para la preparación de otros compuestos de zinc. Es ilustrativa la preparación de carbonato de zinc: [5]
El cloruro de zinc se utiliza como catalizador o reactivo en diversas reacciones realizadas a escala industrial. La hidrólisis parcial del cloruro de benzal en presencia de cloruro de zinc es la ruta principal para obtener cloruro de benzoílo . Sirve como catalizador para la producción de bis(ditiocarbamato de metileno). [5]
La combinación de ácido clorhídrico y ZnCl 2 , conocida como " reactivo de Lucas ", es eficaz para la preparación de cloruros de alquilo a partir de alcoholes. Reacciones similares son la base de rutas industriales desde metanol y etanol respectivamente hasta cloruro de metilo y cloruro de etilo . [40]
El cloruro de zinc es un reactivo común en el ácido de Lewis útil en el laboratorio en química orgánica. [41]
El cloruro de zinc fundido cataliza la conversión de metanol en hexametilbenceno : [42]
Otros ejemplos incluyen catalizar (A) la síntesis de indol de Fischer , [43] y también (B) reacciones de acilación de Friedel-Crafts que involucran anillos aromáticos activados [44] [45]
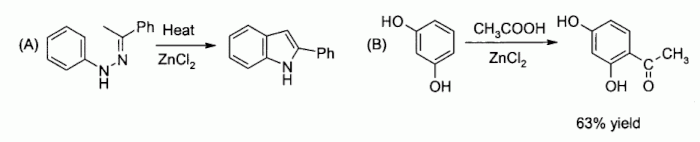
A este último está relacionada la preparación clásica del colorante fluoresceína a partir de anhídrido ftálico y resorcinol , que implica una acilación de Friedel-Crafts . [46] De hecho, esta transformación se ha logrado utilizando incluso la muestra de ZnCl 2 hidratada que se muestra en la imagen de arriba.

El cloruro de zinc también activa los haluros bencílicos y alílicos hacia la sustitución por nucleófilos débiles como los alquenos : [47]

De manera similar, el ZnCl 2 promueve la reducción selectiva con Na[BH 3 (CN)] de haluros terciarios, alílicos o bencílicos a los hidrocarburos correspondientes. [20]
El cloruro de zinc también es un reactivo de partida útil para la síntesis de muchos reactivos de organozinc , como los utilizados en el acoplamiento Negishi catalizado por paladio con haluros de arilo o haluros de vinilo . [48] En tales casos, el compuesto de organozinc generalmente se prepara mediante transmetalación a partir de un organolitio o un reactivo de Grignard , por ejemplo:

Los enolatos de zinc , preparados a partir de enolatos de metales alcalinos y ZnCl 2 , proporcionan control de la estereoquímica en reacciones de condensación aldólica debido a la quelación del zinc. En el ejemplo que se muestra a continuación, el producto treo se vio favorecido sobre el eritro en un factor de 5:1 cuando se usó ZnCl 2 en DME / éter . [49] El quelato es más estable cuando el voluminoso grupo fenilo es pseudoecuatorial en lugar de pseudoaxial , es decir, treo en lugar de eritro .

El uso de cloruro de zinc como fundente, a veces en mezcla con cloruro de amonio (ver también Cloruro de zinc y amonio ), implica la producción de HCl y su posterior reacción con óxidos superficiales.
El cloruro de zinc reacciona con óxidos metálicos (MO) para dar derivados de fórmula idealizada MZnOCl 2 . [50] [ se necesitan citas adicionales ] Esta reacción es relevante para la utilidad de la solución de ZnCl 2 como fundente para soldar : disuelve los óxidos pasivantes y expone la superficie metálica limpia. [50] Los fundentes con ZnCl 2 como ingrediente activo a veces se denominan "fluido de estaño".
El cloruro de zinc forma dos sales con el cloruro de amonio: [NH 4 ] 2 [ZnCl 4 ] y [NH 4 ] 3 [ZnCl 4 ]Cl , que se descomponen al calentarse liberando HCl, tal como lo hace el hidrato de cloruro de zinc. La acción de los fundentes de cloruro de zinc/cloruro de amonio, por ejemplo, en el proceso de galvanización en caliente produce gas H2 y vapores de amoníaco. [51]
Las soluciones acuosas concentradas de cloruro de zinc (más del 64% peso/peso de cloruro de zinc en agua) son capaces de disolver almidón , seda y celulosa . [ cita necesaria ]
En relación con su afinidad por estos materiales, el ZnCl 2 se utiliza como agente ignífugo y en "refrescantes" de telas como Febreze. La fibra vulcanizada se obtiene empapando papel en cloruro de zinc concentrado.
La mezcla de humo de cloruro de zinc ("HC") utilizada en las granadas de humo contiene óxido de zinc, hexacloroetano y polvo granular de aluminio que, cuando se enciende, reacciona para formar humo de cloruro de zinc, carbono y óxido de aluminio , una eficaz cortina de humo . [52]
La ninhidrina reacciona con aminoácidos y aminas para formar un compuesto coloreado "púrpura de Ruhemann" (RP). La pulverización con una solución de cloruro de zinc forma un complejo 1:1 RP: ZnCl(H 2 O) 2 , que se detecta más fácilmente ya que presenta una fluorescencia más intensa que el RP. [53]
Se utilizó cloruro de zinc acuoso diluido como desinfectante con el nombre de "fluido desinfectante de Burnett". [54] Desde 1839, Sir William Burnett promovió su uso como desinfectante y conservante de la madera. [55] La Royal Navy llevó a cabo pruebas sobre su uso como desinfectante a finales de la década de 1840, incluso durante la epidemia de cólera de 1849 ; y al mismo tiempo se llevaron a cabo experimentos sobre sus propiedades conservantes aplicables a las industrias de construcción naval y ferroviaria. Burnett tuvo cierto éxito comercial con su fluido del mismo nombre. Sin embargo, tras su muerte, su uso fue reemplazado en gran medida por el del ácido carbólico y otros productos patentados.
El cloruro de zinc anhidro o sus hidratos no se conocen en la naturaleza. Sin embargo, el monohidrato de hidróxido de cloruro de zinc relacionado se conoce como simonkolleita en la naturaleza. [56]