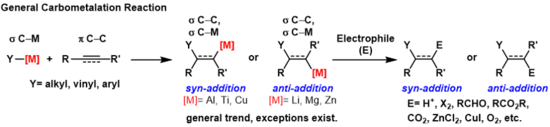
Una carbometalación es cualquier reacción en la que un enlace carbono-metal reacciona con un enlace π carbono-carbono para producir un nuevo enlace σ carbono-carbono y un enlace σ carbono-metal. [1] El enlace carbono-metal resultante puede sufrir más reacciones de carbometalación (oligomerización o polimerización, véase polimerización de Ziegler-Natta ) o puede reaccionar con una variedad de electrófilos, incluidos reactivos halogenantes, carbonilos , oxígeno y sales inorgánicas para producir diferentes reactivos organometálicos. Las carbometalaciones se pueden realizar en alquinos y alquenos para formar productos con alta pureza geométrica o enantioselectividad , respectivamente. Algunos metales prefieren dar el producto de antiadición con alta selectividad y algunos producen el producto de adición sin. El resultado de los productos de adición sin y anti está determinado por el mecanismo de la carbometalación.
La carboboración es una de las reacciones de carbometalación más versátiles. Véase Carboboración .
La reacción de carboaluminización es catalizada más comúnmente por dicloruro de zirconoceno (o catalizador relacionado). Algunas carboaluminizaciones se realizan con complejos de titanoceno . [1] Esta reacción a veces se denomina carboaluminización asimétrica de alquenos catalizada por Zr (ZACA) o metilaluminización de alquinos catalizada por Zr (ZMA). [2]

Los reactivos de trialquilaluminio más comunes para esta transformación son el trimetilaluminio , el trietilaluminio y, a veces, el triisobutilaluminio . Cuando se utilizan reactivos de trialquilaluminio que tienen beta-hidruros , las eliminaciones y las reacciones de hidroaluminio se convierten en procesos competitivos. El mecanismo general de la reacción de ZMA se puede describir como la primera formación de las especies catalíticas activas a partir del precatalizador dicloruro de zirconoceno a través de su reacción con trimetilaluminio. Primero se produce la transmetalación de un metilo del aluminio al zirconio. A continuación, la abstracción de cloruro por el aluminio crea una especie de zirconio catiónico que está estrechamente asociada con un complejo de aluminio aniónico. Este catión de zirconio puede coordinar un alqueno o alquino donde luego tiene lugar la inserción migratoria de un metilo. La especie de vinilo o alquil zirconio resultante puede experimentar una transmetalación reversible, pero estereorretentiva con un organoaluminio para proporcionar el producto de carboaluminización y la regeneración del catalizador de dicloruro de zirconoceno. Este proceso generalmente proporciona el producto de adición sin; Sin embargo, existen condiciones para proporcionar el producto antiadición a través de un mecanismo modificado.
Los alquinos protegidos con trimetilsililo (TMS), los alquinos de trimetilgermanio y los alquinos terminales pueden producir productos anticarboaluminización a temperatura ambiente o a temperaturas elevadas si hay un grupo coordinador cerca del sustrato . [3] En estas reacciones, primero se produce la sincarboaluminización según el mecanismo descrito anteriormente. Luego, otro equivalente de aluminio que está coordinado con el grupo director puede desplazar al vinilo aluminio, invirtiendo la geometría en el carbono donde se produce el desplazamiento.
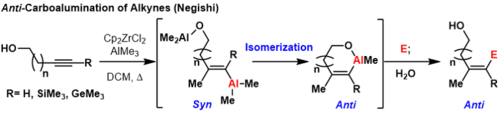
Esto forma un metalociclo termodinámicamente favorable para evitar inversiones posteriores. Formalmente, este proceso proporciona productos anti-carboaluminización que pueden ser extinguidos con electrófilos. Una limitación de esta metodología es que el grupo director debe estar lo suficientemente cerca del enlace π carbono-carbono para formar un anillo termodinámicamente favorable o de lo contrario se formarán mezclas de isómeros geométricos .
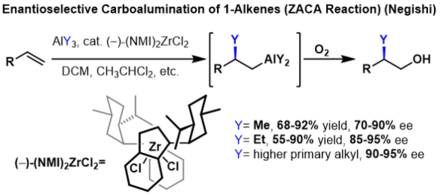
La carboaluminización de alquenos para formar alcanos sustituidos puede volverse enantioselectiva si se utilizan alquenos proquirales . En estas reacciones, se utiliza un catalizador de indenil circonio quiral para inducir la enantioselectividad. En estas reacciones, se obtuvieron altas enantioselectividades para varios reactivos de trialquilaluminio; sin embargo, el rendimiento disminuye drásticamente con cada carbono adicional de la cadena alquílica en el reactivo de trialquilaluminio. [2]

La carbolitiación es la adición de un reactivo de organolitio a través de un enlace pi carbono-carbono. Los reactivos de organolitio utilizados en esta transformación pueden ser comerciales (como n-butillitio ) o pueden generarse a través de desprotonación o intercambio litio-halógeno . [4] [5] Existen ejemplos intermoleculares e intramoleculares de carbolitiación y pueden usarse en síntesis para generar complejidad. Los organolitios son sustancias químicas altamente reactivas y, a menudo, el reactivo de organolitio resultante generado a partir de la carbolitiación puede continuar reaccionando con electrófilos o material de partida restante (lo que da como resultado polimerización ). [4] Esta reacción se ha vuelto enantioselectiva [6] [7] mediante el uso de esparteína , que puede quelar el ion litio e inducir quiralidad . [4] Hoy en día, esta no es una estrategia común debido a la escasez de esparteína natural. Sin embargo, los avances recientes en la síntesis de sustitutos de esparteína y su aplicación efectiva en la carbolitiación han reactivado el interés en esta estrategia. [8]
Otra demostración de este tipo de reacción es una ruta alternativa al tamoxifeno a partir de difenilacetileno y etil-litio : [9] El electrófilo capturador aquí es el borato de triisopropilo que forma el ácido borónico R–B(OH) 2 . El segundo paso que completa el tamoxifeno es una reacción de Suzuki .
Como consecuencia de la alta reactividad de los organolitios como bases fuertes y nucleófilos fuertes , el alcance del sustrato de la carbolitiación generalmente se limita a productos químicos que no contienen grupos funcionales ácidos o electrófilos .
Debido a la nucleofilia reducida de los reactivos de Grignard (organomagnesio) y de organocinc , las reacciones de carbomagnesiación y carbocincación no catalizadas normalmente solo se observan en alquenos y alquinos activados o tensados . [10] Por ejemplo, los grupos que extraen electrones como los ésteres , nitrilos o sulfonas deben estar en conjugación con el sistema π carbono-carbono (véase la reacción de Michael ) o un grupo director como un alcohol o una amina debe estar cerca para dirigir la reacción. Estas reacciones pueden ser catalizadas por una variedad de metales de transición como el hierro, [10] [11] el cobre, [10] el circonio, [12] el níquel, [10] [13] el cobalto [14] y otros.
Un ejemplo ilustrativo es la reacción catalizada por Fe del metilfenilacetileno con bromuro de fenilmagnesio , que genera un intermedio de vinilmagnesio. La hidrólisis produce el difenilalqueno: [11] [15]
Las carbopaladaciones pueden ser una descripción del paso elemental de una reacción catalizada por un catalizador de paladio ( reacción de Mizoroki-Heck ) [16] y también pueden referirse a una reacción de carbometalación con un catalizador de paladio (difuncionalización de alquenos, [17] hidrofuncionalización , [18] [19] o Heck reductiva [20] ).