Un aminoácido de cadena ramificada ( AACR ) es un aminoácido que tiene una cadena lateral alifática con una ramificación (un átomo de carbono central unido a tres o más átomos de carbono). Entre los aminoácidos proteinogénicos , hay tres AACR: leucina , isoleucina y valina . [1] Los AACR no proteinogénicos incluyen el ácido 2-aminoisobutírico y la aloisoleucina .


Los tres BCAA proteinogénicos se encuentran entre los nueve aminoácidos esenciales para los humanos, representando el 35% de los aminoácidos esenciales en las proteínas musculares y el 40% de los aminoácidos preformados requeridos por los mamíferos. [2] La síntesis de BCAA ocurre en todas las ubicaciones de las plantas, dentro de los plástidos de la célula, como lo determina la presencia de ARNm que codifican enzimas en la vía metabólica. [3] [4] [5] La oxidación de BCAA puede aumentar la oxidación de ácidos grasos y desempeñar un papel en la obesidad. Fisiológicamente, los BCAA asumen funciones en el sistema inmunológico y en la función cerebral. Los BCAA se descomponen de manera efectiva por las enzimas deshidrogenasa y descarboxilasa expresadas por las células inmunes, y son necesarios para el crecimiento y la proliferación de linfocitos y la actividad de los linfocitos T citotóxicos. [4] Por último, los BCAA comparten la misma proteína de transporte al cerebro con los aminoácidos aromáticos (Trp, Tyr y Phe). Una vez en el cerebro, los BCAA pueden tener un papel en la síntesis de proteínas, la síntesis de neurotransmisores y la producción de energía. [4]
En 2002 , la Junta de Alimentos y Nutrición (FNB) del Instituto de Medicina de los Estados Unidos estableció las cantidades diarias recomendadas (RDA) de aminoácidos esenciales. En el caso de la leucina, para adultos de 19 años o más, 42 mg/kg de peso corporal/día; en el caso de la isoleucina, 19 mg/kg de peso corporal/día; en el caso de la valina, 24 mg/kg de peso corporal/día. [6] Para una persona de 70 kg (154 lb), esto equivale a 2,9, 1,3 y 1,7 g/día. Las dietas que cumplen o superan la RDA de proteínas totales (0,8 g/kg/día; 56 gramos para una persona de 70 kg), cumplen o superan las RDA de aminoácidos de cadena ramificada.
Cinco enzimas participan en las vías de síntesis paralelas de isoleucina, valina y leucina: treonina deshidrogenasa, acetohidroxiácido sintasa, cetoácido reductoisomerasa, dihidroxiácido deshidrogenasa y aminotransferasa . [3] La treonina deshidrogenasa cataliza la desaminación y deshidratación de la treonina a 2-cetobutirato y amoníaco. La isoleucina forma un ciclo de retroalimentación negativa con la treonina deshidrogenasa. La acetohidroxiácido sintasa es la primera enzima de la vía paralela que realiza la reacción de condensación en ambos pasos: condensación de piruvato a acetolactato en la vía de la valina y condensación de piruvato y 2-cetobutirato para formar acetohidroxibutirato en la vía de la isoleucina. A continuación, la cetoácido reductoisomerasa reduce los acetohidroxiácidos del paso anterior para producir dihidroxiácidos en las vías de la valina y la isoleucina. La dihidroxiácido deshidrogenasa convierte los dihidroxiácidos en el siguiente paso. El paso final de la vía paralela lo lleva a cabo la aminotransferasa, que produce los productos finales valina e isoleucina. [3] Una serie de cuatro enzimas más (isopropilmalato sintasa, isopropilmalato isomerasa, isopropilmalato deshidrogenasa y aminotransferasa) son necesarias para la formación de leucina a partir de 2-oxolsovalerato. [3]
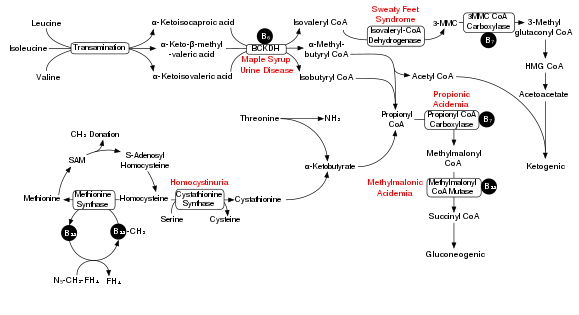
La degradación de los aminoácidos de cadena ramificada involucra al complejo deshidrogenasa de alfa-cetoácido de cadena ramificada (BCKDH). Una deficiencia de este complejo conduce a una acumulación de los aminoácidos de cadena ramificada ( leucina , isoleucina y valina ) y sus subproductos tóxicos en la sangre y la orina, lo que le da a la afección el nombre de enfermedad de la orina con olor a jarabe de arce . Por otro lado, la actividad descontrolada de este complejo causa deficiencia de la quinasa deshidrogenasa de cetoácido de cadena ramificada .
El complejo BCKDH convierte los aminoácidos de cadena ramificada en derivados de acil-CoA , que después de reacciones posteriores se convierten en acetil-CoA o succinil-CoA que ingresan al ciclo del ácido cítrico . [7]
Las enzimas involucradas son la aminotransferasa de cadena ramificada y la 3-metil-2-oxobutanoato deshidrogenasa .
En un modelo de rata de enfermedad de la orina con olor a jarabe de arce , la administración aguda de BCAA aumenta el daño del ADN en la región del hipocampo del cerebro. [8] La Figura cercana muestra la vía de degradación de los BCAA y específicamente el papel clave de la BCKDH inadecuada en la enfermedad de la orina con olor a jarabe de arce. La administración crónica de BCAA, en comparación con la administración aguda, aumentó el daño del ADN no solo en el hipocampo sino también en la región del cuerpo estriado del cerebro. [8] El tratamiento antioxidante pudo prevenir el daño del ADN en estas regiones del cerebro, lo que sugiere que los BCAA causan daño del ADN a través de la producción de estrés oxidativo .
Mientras que la mayoría de los aminoácidos se oxidan en el hígado, los BCAA se oxidan principalmente en el músculo esquelético y otros tejidos periféricos. [4] Se probaron los efectos de la administración de BCAA en el crecimiento muscular en el diafragma de la rata y se concluyó que no solo una mezcla de BCAA sola tiene el mismo efecto en el crecimiento que una mezcla completa de aminoácidos, sino que una mezcla de aminoácidos con todos menos BCAA no afecta el crecimiento muscular del diafragma de la rata. [9] La administración de isoleucina o valina solas no afectó el crecimiento muscular, aunque la administración de leucina sola parece ser casi tan efectiva como la mezcla completa de BCAA. La leucina activa indirectamente la quinasa p70 S6 y estimula el ensamblaje del complejo eIF4F , que son esenciales para la unión del ARNm en la iniciación de la traducción. [9] La quinasa P70 S6 es parte de la vía de señalización del complejo de la diana de rapamicina en mamíferos (mTOR) y se ha demostrado que permite la hipertrofia adaptativa y la recuperación del músculo de la rata. [10] La infusión de proteínas en reposo estimula la síntesis proteica 30 minutos después del inicio de la infusión, y la síntesis proteica se mantiene elevada durante otros 90 minutos. [11] La infusión de leucina en reposo produce un efecto estimulante de seis horas y aumenta la síntesis proteica por fosforilación de la quinasa p70 S6 en los músculos esqueléticos. [11] Después del ejercicio de resistencia, sin la administración de BCAA, una sesión de ejercicio de resistencia no afecta la fosforilación de mTOR e incluso produce una disminución en la fosforilación de Akt. Se descubrió cierta fosforilación de la quinasa p70 S6. Cuando se administraron BCAA después de una sesión de entrenamiento, la fosforilación suficiente de la quinasa p70 S6 y S6 indicó la activación de la cascada de señalización. [11]
Además de la señalización celular, la vía mTOR también desempeña un papel en el crecimiento de las células beta que conduce a la secreción de insulina . [12] La alta glucosa en la sangre inicia el proceso de la vía de señalización mTOR, en la que la leucina juega un papel indirecto. [10] [13] La combinación de glucosa, leucina y otros activadores hace que mTOR comience a señalar la proliferación de células beta y la secreción de insulina. Las concentraciones más altas de leucina causan hiperactividad en la vía mTOR y la quinasa S6 se activa, lo que conduce a la inhibición del sustrato del receptor de insulina a través de la fosforilación de serina. [12] [13] En la célula, la mayor actividad del complejo mTOR provoca la incapacidad final de las células beta para liberar insulina y el efecto inhibidor de la quinasa S6 conduce a la resistencia a la insulina en las células , lo que contribuye al desarrollo de la diabetes tipo 2. [12]
La metformina es capaz de activar la quinasa AMP que fosforila las proteínas involucradas en la vía mTOR, además de conducir a la progresión del complejo mTOR de su estado inactivo a su estado activo. [12] Se sugiere que la metformina actúa como un inhibidor competitivo del aminoácido leucina en la vía mTOR.
Los BCAA tienen un efecto similar a la insulina sobre la glucosa , lo que provoca una reducción de los niveles de glucosa. Los BCAA que se ingieren antes del ejercicio pueden ser oxidados por el músculo esquelético y utilizados como energía durante el ejercicio, lo que reduce la necesidad de que el hígado aumente los niveles de glucogenólisis . Durante el ejercicio anaeróbico, las moléculas de piruvato que resultan del metabolismo de la glucosa se convierten en ácido láctico , cuya acumulación puede provocar acidosis metabólica con niveles de pH tan bajos como 6,4. [14] Los niveles altos de ácido láctico hacen que el metabolismo de la glucosa se detenga para reducir aún más la reducción del pH. Se ha demostrado que la suplementación con BCAA disminuye los niveles de ácido láctico en el músculo, lo que permite que continúe el metabolismo de la glucosa. [15] Esto da como resultado tasas reducidas de glucogenólisis en el hígado y, en consecuencia, niveles plasmáticos más bajos de glucosa. Sin embargo, los estudios realizados sobre los efectos a largo plazo de los BCAA sobre los niveles de glucosa han demostrado que la suplementación constante de BCAA no tiene un efecto notable en los niveles de glucosa en sangre fuera del ejercicio. [15]
Los BCAA reducen los niveles de ácidos grasos libres circulantes (FFA) en la sangre. [15] Los FFA compiten por los sitios de unión en la albúmina con el triptófano , y cuando los niveles de FFA en la sangre disminuyen, los niveles de triptófano libre también disminuyen a medida que la albúmina se une más. Durante el ejercicio, los niveles de triptófano libre que ingresan al cerebro aumentan, lo que provoca un aumento de 5-hidroxitriptamina (5-HT, también conocida como serotonina ), un contribuyente a la sensación de fatiga . A través de su reducción en los niveles de FFA en la sangre, los BCAA pueden ayudar a reducir los niveles de triptófano libre que ingresa al cerebro y ayudar a reducir la sensación de fatiga como resultado del esfuerzo. [16] La reducción en la absorción de triptófano en el cerebro conduce a una reducción en la síntesis y liberación de serotonina (en ratas. [17] ) La reducción de la serotonina puede ser tan grande como 90%; Los niveles bajos de serotonina disminuyen la sensación de fatiga, pero también conducen a una falta de concentración, un control deficiente de los impulsos, un comportamiento agresivo y una mala planificación.
Los BCAA también inhiben la absorción de tirosina en el cerebro (la tirosina es otro aminoácido aromático, como el triptófano); la absorción reducida deprime la síntesis y liberación de catecolaminas en el cerebro. Las catecolaminas están asociadas con un mejor rendimiento físico. Las reducciones simultáneas en la síntesis de catecolaminas y serotonina pueden explicar el efecto relativamente neutral de los BCAA en el rendimiento físico. [17]
También se ha descubierto que los BCAA reducen el aumento de los niveles séricos de amoníaco que se produce durante el ejercicio. Esto se hace aumentando la cantidad de amoníaco utilizado en la síntesis de glutamina , lo que evita una acumulación excesiva de amoníaco en la sangre. [15] El aumento de los niveles de amoníaco en el cerebro da como resultado niveles más bajos de GABA y glutamato , lo que provoca un aumento de la fatiga central . El aumento de los niveles de amoníaco en el tejido muscular también aumenta la actividad de la fosfofructoquinasa (PFK), lo que conduce a un aumento del ácido láctico, un importante contribuyente a la fatiga muscular. [18]
Además, se ha demostrado que la suplementación con BCAA disminuye los niveles de creatina quinasa en las células musculares después del ejercicio. La creatina quinasa es un indicador de daño muscular y es responsable de transferir un grupo fosfato del ATP para crear una molécula de fosfocreatina . [19] Se ha demostrado que la suplementación con BCAA disminuye los niveles de creatina quinasa, lo que conduce a niveles más altos de ATP intracelular y una menor sensación de fatiga. [20] Ver también DOMS .
Los BCAA dietéticos se han utilizado en un intento de tratar algunos casos de encefalopatía hepática . [21] Pueden tener el efecto de aliviar los síntomas de la encefalopatía hepática, pero no hay evidencia de que beneficien las tasas de mortalidad, la nutrición o la calidad de vida en general, ya que se necesitan más investigaciones. [22]
Algunos estudios han sugerido un posible vínculo entre una alta incidencia de esclerosis lateral amiotrófica (ELA) entre jugadores profesionales de fútbol americano y futbolistas italianos, y ciertos suplementos deportivos que incluyen BCAA. [23] En estudios con ratones, se ha demostrado que los BCAA causan hiperexcitabilidad celular similar a la que se observa habitualmente en pacientes con ELA. El mecanismo subyacente propuesto es que la hiperexcitabilidad celular da como resultado una mayor absorción de calcio por parte de la célula y, por lo tanto, provoca la muerte celular, específicamente de las células neuronales que tienen capacidades de amortiguación de calcio particularmente bajas. [23] Sin embargo, aún queda por establecer por completo cualquier vínculo entre los BCAA y la ELA. Si bien los BCAA pueden inducir una hiperexcitabilidad similar a la observada en ratones con ELA, el trabajo actual no muestra si una dieta enriquecida con BCAA, administrada durante un período prolongado, realmente induce síntomas similares a los de la ELA. [23]
Los niveles sanguíneos de los BCAA están elevados en humanos obesos y resistentes a la insulina y en modelos de ratones y ratas con diabetes inducida por la dieta, lo que sugiere la posibilidad de que los BCAA contribuyan a la patogénesis de la obesidad y la diabetes. [24] [25] Las dietas restringidas en BCAA mejoran la tolerancia a la glucosa y promueven la delgadez en ratones de peso normal, [26] restauran la sensibilidad a la insulina y el peso corporal normal en ratones obesos [27] y promueven la sensibilidad a la insulina en ratas obesas. [28] En ratones delgados y obesos, estos beneficios de la restricción de BCAA están mediados por la isoleucina y la valina, y no por la restricción de leucina. [29]
La restricción de BCAA en la dieta extiende la esperanza de vida en las moscas, [30] mientras que la restricción de BCAA en ratones extiende la esperanza de vida de los machos y reduce la fragilidad, pero no extiende la esperanza de vida de las hembras. [31] En ratones, la suplementación dietética con BCAA solos disminuye la esperanza de vida y promueve la obesidad. [32] Sin embargo, el consumo de un suplemento de aminoácidos esenciales enriquecido con BCAA extiende la esperanza de vida de los ratones. [33]