
La crioconservación de recursos genéticos animales es una estrategia en la que muestras de materiales genéticos animales se conservan criogénicamente . [1]
Los recursos genéticos animales, según la definición de la Organización de las Naciones Unidas para la Agricultura y la Alimentación , son "aquellas especies animales que se utilizan, o pueden utilizarse, para la producción de alimentos y la agricultura, y las poblaciones dentro de cada una de ellas. Estas poblaciones dentro de cada especie pueden clasificarse como poblaciones silvestres y asilvestradas , razas locales y poblaciones primarias, razas estandarizadas , líneas seleccionadas, variedades, cepas y cualquier material genético conservado; todos los cuales se clasifican actualmente como Razas". [2] Los materiales genéticos que normalmente se conservan criogénicamente incluyen esperma , ovocitos , embriones y células somáticas . [3] [4] Las instalaciones criogénicas se denominan bancos de genes y pueden variar mucho en tamaño, generalmente de acuerdo con los recursos económicos disponibles. Deben poder facilitar la recolección, el procesamiento y el almacenamiento a largo plazo de germoplasma , todo ello de manera higiénica y organizada. Los bancos de genes deben mantener una base de datos precisa y hacer que la información y los recursos genéticos sean accesibles para facilitar adecuadamente la crioconservación. [1] La crioconservación es una estrategia de conservación ex situ que a menudo coexiste con la conservación in situ para proteger y preservar la genética del ganado . [5]
La crioconservación de los recursos genéticos del ganado se realiza principalmente para preservar la genética de las poblaciones de interés, como las razas autóctonas, también conocidas como razas locales o menores. El material puede almacenarse porque los individuos comparten genes y fenotipos específicos que pueden ser valiosos o tener un valor potencial para los investigadores o criadores. Por lo tanto, uno de los principales objetivos sigue siendo preservar el acervo genético de las razas locales que pueden estar amenazadas. [6] La genética del ganado autóctono suele verse amenazada por factores como la globalización , la modernización , los cambios en los sistemas de producción, la introducción inapropiada de razas principales, la deriva genética , la endogamia , el mestizaje , el cambio climático , los desastres naturales , las enfermedades, los cambios culturales y la urbanización. [7] [8] [9] El ganado autóctono es fundamental para el desarrollo agrícola sostenible y la seguridad alimentaria , debido a su: adaptación al medio ambiente y a las enfermedades endémicas, su parte indispensable en los sistemas de producción locales, su importancia cultural y su importancia para las economías rurales locales . [4] [9] Los recursos genéticos de razas menores tienen valor para los agricultores locales, los consumidores de los productos, las empresas privadas y los inversores interesados en el cruzamiento de razas, las asociaciones de razas, los gobiernos, los que realizan investigación y desarrollo, y las organizaciones no gubernamentales. [1] [10] Por lo tanto, los gobiernos nacionales y las organizaciones no gubernamentales, como The Livestock Conservancy , han realizado esfuerzos para fomentar la conservación de la genética del ganado mediante la crioconservación, así como mediante otras estrategias ex situ e in situ . [7] [11] Los especímenes criogénicos de recursos genéticos del ganado se pueden preservar y utilizar durante períodos prolongados de tiempo. [12] Esta ventaja hace que la crioconservación sea beneficiosa particularmente para las razas amenazadas que tienen poblaciones de razas bajas. Los especímenes preservados criogénicamente se pueden utilizar para revivir razas en peligro o extintas , para la mejora de la raza, el cruzamiento, la investigación y el desarrollo. Sin embargo, la crioconservación puede ser una estrategia costosa y requiere un compromiso higiénico y económico a largo plazo para que los germoplasmas sigan siendo viables. [1]La crioconservación también puede enfrentar desafíos únicos según la especie, ya que algunas especies tienen una tasa de supervivencia reducida del germoplasma congelado. [3] [13] [14]
La crioconservación es el proceso de congelación de células y tejidos utilizando nitrógeno líquido para alcanzar temperaturas extremadamente bajas con la intención de utilizar la muestra preservada para prevenir la pérdida de diversidad genética. [15] El semen, los embriones, los ovocitos, las células somáticas , el ADN nuclear y otros tipos de biomateriales como la sangre y el suero se pueden almacenar mediante criopreservación, con el fin de preservar los materiales genéticos. [3] [4] El principal beneficio de la crioconservación es la capacidad de guardar germoplasma durante períodos prolongados de tiempo, manteniendo así la diversidad genética de una especie o raza. [12] Hay dos técnicas comunes de criopreservación: la congelación lenta y la vitrificación. La congelación lenta ayuda a eliminar el riesgo de cristales de hielo intracelulares. [16] Si se forman cristales de hielo en las células, puede haber daño o destrucción del material genético. La vitrificación es el proceso de congelación sin la formación de cristales de hielo. [17]
La crioconservación es una herramienta indispensable para el almacenamiento de material genético de origen animal y seguirá siendo útil para la conservación del ganado en el futuro. La crioconservación sirve como una forma de preservar germoplasma, lo que es particularmente beneficioso para las razas amenazadas. El ganado autóctono puede conservarse por diversas razones, incluida la preservación de la genética local, su importancia en las tradiciones locales y su valor para la identidad y el patrimonio cultural de la zona. [18] La pérdida de la diversidad ganadera regional podría aumentar la inestabilidad, reducir las posibilidades futuras y desafiar los sistemas de producción. [9] Además, el mantenimiento de las razas autóctonas puede ayudar a la preservación de los estilos de vida y los medios de subsistencia tradicionales, incluso proporcionando ingresos a través del turismo cultural. [19] Las razas autóctonas pueden contribuir a las economías y los sistemas de producción locales al utilizar tierras que no son adecuadas para la producción agrícola para producir productos alimenticios, así como proporcionar pieles, estiércol y fuerza de tiro. Por lo tanto, la conservación y el progreso de estas razas son de suma importancia para la seguridad alimentaria y la sostenibilidad. [7]
Otro factor beneficioso de la crioconservación del ganado autóctono es la seguridad alimentaria y el desarrollo económico. [20] El ganado autóctono suele tener rasgos beneficiosos relacionados con la adaptación al clima local y a las enfermedades que se pueden incorporar a las principales razas mediante prácticas de crioconservación. [21] La crioconservación es una estrategia favorable porque permite almacenar germoplasma durante largos períodos de tiempo en un área pequeña y confinada. Un beneficio adicional de la crioconservación es la capacidad de preservar el material biológico de las células maternas y paternas y mantener la viabilidad durante largos períodos de tiempo. [3] [9] La crioconservación se ha utilizado con éxito como estrategia de conservación para especies y razas que desde entonces han estado en peligro de extinción. Un inconveniente es que la crioconservación solo se puede realizar si se ha realizado una preparación previa. [4] Con la preparación adecuada de la recolección y el mantenimiento del material genético, este método es muy beneficioso para la conservación de ganado raro y en peligro de extinción. La crioconservación puede servir como plan de contingencia cuando es necesario recuperar una población de una raza o cuando una raza se ha extinguido, así como para mejorarla. Este proceso beneficia a las empresas y a los investigadores al poner a disposición material genético. [1]
El apoyo de numerosas partes interesadas hace posible este proceso en el establecimiento y funcionamiento de la crioconservación. Antes de ejecutar cada fase, todas las partes interesadas participantes deben recibir información sobre la posible fase inminente. Esto incluiría informar a las partes interesadas de sus responsabilidades y recibir su consentimiento para el proceso de crioconservación. [1] Las posibles partes interesadas dentro del proceso de crioconservación podrían incluir:
Existen varias formas de recolectar el material genético en función del tipo de germoplasma. [ cita requerida ]
La congelación del semen es una técnica de uso común en la industria de la agricultura animal moderna, que está bien investigada con métodos establecidos [ 22] El semen a menudo se recolecta utilizando una vagina artificial , electroeyaculación , técnica de mano enguantada, acariciamiento abdominal o recolección de esperma epididimario. Las técnicas de recolección preferidas varían según la especie y las herramientas disponibles. La paciencia y la técnica son claves para una recolección exitosa de semen. [23] Hay varios estilos y tipos de vaginas artificiales que se pueden usar según la raza y la especie del macho. Durante este proceso, el pene ingresa a un tubo que tiene la presión y temperatura aproximadas de la vagina de la hembra. Hay una bolsa desechable dentro del tubo que recolecta el semen. Durante este proceso, puede ser beneficioso tener un animal provocador, un animal utilizado para provocar sexualmente pero no para fecundar al animal, para aumentar la excitación del macho. [23] La electroeyaculación es un método de recolección de semen en la industria ganadera porque produce semen de alta calidad. Sin embargo, este proceso requiere que el animal esté entrenado y bien sujeto, por lo que no es ideal cuando se trabaja con animales salvajes o asilvestrados. Al realizar este proceso, el electroeyaculador se inserta en el recto del macho. [24] El electroeyaculador estimula al macho provocando una eyaculación, después de lo cual se recoge el semen. La técnica de recogida con guantes se utiliza principalmente en la industria porcina. Durante este proceso, el verraco monta un muñeco, mientras que el manipulador agarra el pene del verraco entre las crestas de sus dedos y recoge el semen. [25] La caricia abdominal se utiliza exclusivamente en la industria avícola. Durante la técnica, un técnico sujetará al ave, mientras un segundo técnico le masajea la cloaca. [26] Sin embargo, tanto las heces como el semen salen del cuerpo del ave macho a través de la cloaca, por lo que la calidad del semen suele ser baja. [27]
La recolección de embriones es más exigente y requiere más entrenamiento que la recolección de semen porque los órganos reproductores femeninos están ubicados dentro de la cavidad corporal. La superovulación es una técnica utilizada para que una hembra libere más ovocitos de lo normal. Esto se puede lograr utilizando hormonas para manipular los órganos reproductores de la hembra. Las hormonas utilizadas son típicamente similares a la gonadotropina, lo que significa que estimulan las gónadas. [28] La hormona folículo estimulante es la hormona preferida en el ganado vacuno, las ovejas y las cabras. Mientras que en los cerdos, se prefiere la gonadotropina coriónica equina. Sin embargo, esto no se hace comúnmente en la industria porcina porque las cerdas jóvenes y adultas (cerdas hembras) ovulan naturalmente más de un ovocito a la vez. La superovulación puede ser difícil porque no todas las hembras responderán de la misma manera y el éxito variará según la especie. Una vez que la hembra ha liberado los ovocitos, estos son fertilizados internamente (in vivo) y expulsados de su cuerpo. La fertilización in vivo es más exitosa que la fertilización in vitro. [29] En el ganado, por lo general se extraen 10 o más embriones del proceso de lavado. Para lavar el útero, un técnico primero sellará el cuello uterino de la hembra y agregará líquido, lo que permite que el óvulo salga de los cuernos uterinos y se coloque en un cilindro para su análisis. Este proceso generalmente demora 30 minutos o menos. [30] Los técnicos pueden determinar el sexo del embrión, lo que puede ser especialmente beneficioso en la industria láctea porque es más deseable que el embrión sea femenino. [31] La vitrificación es el método preferido de congelación de embriones porque produce embriones de mayor calidad. [32] Es crucial que los técnicos manipulen los embriones con cuidado y los congelen dentro de las 3 a 4 horas para preservar la viabilidad del mayor porcentaje de embriones. [1]
Los ovocitos se pueden recolectar de la mayoría de las especies de mamíferos. La recolección convencional de ovocitos es cuando se extraen los ovarios de un animal donante; esto se hace póstumamente en instalaciones de sacrificio. [33] Los ovarios se mantienen calientes mientras se llevan de regreso a un laboratorio para la recolección de ovocitos. Mantener los ovarios calientes ayuda a aumentar la tasa de éxito de la fertilización. [33] Una vez recolectados, los ovocitos se evalúan y se clasifican en pequeños, medianos y grandes, y luego se maduran durante 20 a 23 horas. [34] Esta técnica simple y económica puede dar lugar a unos 24 ovocitos recolectados de un bovino. La recolección convencional de ovocitos es especialmente útil para las hembras que mueren inesperadamente o que no pueden reproducirse debido a una lesión. Una segunda opción para la recolección de ovocitos es utilizar el método de recolección de ovocitos guiado por ecografía transvaginal, también conocido como TUGA. La técnica de recolección varía ligeramente según la especie, pero los métodos generales de recolección son los mismos: se inserta una aguja en cada folículo ovárico y se extrae mediante vacío. El principal beneficio de utilizar este método es la capacidad de ampliar la productividad reproductiva a lo largo de la vida, o el número de días productivos que un animal se encuentra en su ciclo estral . Las vacas y yeguas preñadas continúan desarrollando nuevos folículos hasta la mitad del embarazo. Por lo tanto, TUGA se puede utilizar para aumentar sustancialmente la aptitud de un individuo porque la hembra tiene entonces el potencial de producir más de una cría por gestación. [35]
Las células somáticas son un recurso adicional que se puede recuperar para el banco de genes, en particular en casos de emergencia en los que no se pueden recolectar o almacenar gametos. Los tejidos se pueden tomar de animales vivos o poco después de la muerte. Estos tejidos se pueden guardar mediante criopreservación o deshidratación. Las células sanguíneas también pueden ser útiles para el análisis de ADN, como por ejemplo para comparar la homocigosidad [36] [37]. La FAO recomienda que se extraigan dos viales de sangre para reducir la posibilidad de que se pierdan todas las muestras de un animal en particular. El ADN se puede extraer utilizando kits comerciales, lo que hace que esta sea una estrategia asequible y accesible para recolectar germoplasma. [1]
Existen dos métodos de congelación para criopreservación: congelación lenta y vitrificación. [38]

Durante la congelación lenta, las células se colocan en un medio que se enfría por debajo del punto de congelación utilizando nitrógeno líquido. Esto hace que se forme una masa de hielo en el medio. A medida que el agua del medio se congela, aumenta la concentración de azúcares, sales y crioprotectores. Debido a la ósmosis, el agua de las células ingresa al medio para mantener iguales las concentraciones de azúcares, sales y crioprotectores. El agua que sale de las células finalmente se congela, lo que hace que más agua se difunda fuera de la célula. Finalmente, la parte no congelada (celular) se vuelve demasiado viscosa para que se formen cristales de hielo dentro de la célula. [1]
La segunda técnica de crioconservación es la vitrificación o congelación rápida. La vitrificación es la transformación de un estado líquido a sólido sin la formación de cristales. El proceso y la mecánica de la vitrificación son similares a la congelación lenta, la diferencia radica en la concentración del medio. El método de vitrificación aplica un medio seleccionado que tiene una mayor concentración de soluto para que el agua salga de las células por ósmosis. El medio está lo suficientemente concentrado para que todo el agua intracelular salga sin necesidad de reconcentrarlo. La mayor concentración del medio en la vitrificación permite que los germoplasmas se congelen más rápidamente que con la congelación lenta. La vitrificación se considera la técnica más eficaz para congelar germoplasmas. [16]
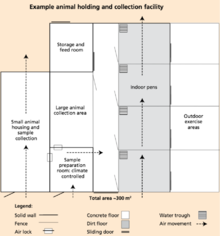
Al diseñar una instalación, hay varios aspectos que se deben tener en cuenta, como la bioseguridad, la seguridad y la eficiencia de los trabajadores y el bienestar animal. Se requiere una infraestructura diversa para recolectar y almacenar material genético con éxito. Los edificios necesarios dependen del tamaño de las instalaciones, así como de la extensión de las operaciones. [1]
La bioseguridad, una medida de gestión utilizada para prevenir la transmisión de enfermedades y agentes patógenos en las instalaciones, es importante tenerla en cuenta al diseñar una instalación. [39] Para lograr un alto nivel de bioseguridad, las instalaciones de recolección deben ubicarse lo más lejos posible entre sí, así como de las granjas. Según las recomendaciones de la FAO, las instalaciones deben estar "al menos a 3 km de las granjas u otros riesgos biológicos y a 1 km de las carreteras principales y vías férreas". [1] La separación entre las instalaciones de recolección y las granjas circundantes puede mejorar la bioseguridad, ya que las plagas, como las moscas y los ratones, tienen el potencial de viajar de la granja a la instalación y viceversa. Otros agentes patógenos pueden viajar por el aire a través del viento, lo que aumenta la importancia de la separación de las granjas y el saneamiento y la ventilación adecuados. Además, se utiliza una cerca perimetral para evitar que ingresen a las instalaciones amenazas potenciales que podrían causar contaminación al germoplasma, como personal no autorizado o animales no deseados. Los animales pueden alojarse en corrales ubicados dentro o fuera de un establo, siempre que se encuentren dentro de la cerca perimetral. Cuando es necesaria la interacción con objetos externos, como camiones de alimentación o personal veterinario, se requiere una sanidad completa para disminuir el riesgo de contaminación. Siempre existe la posibilidad de que la enfermedad se propague entre los animales cuyos datos biológicos se están recopilando o de un animal a un ser humano. Un ejemplo de una enfermedad que puede propagarse fácilmente a través del germoplasma es el síndrome reproductivo y respiratorio porcino, también conocido como PRRS. Una enfermedad altamente contagiosa entre cerdos, el PRRS hace que los productores pierdan millones de dólares anualmente. La enfermedad puede transmitirse a través del semen de verraco. [40] Por lo tanto, la bioseguridad es particularmente importante cuando se insertará material genético en otro animal para prevenir la propagación de tales enfermedades. [ cita requerida ]
La seguridad de los trabajadores es siempre una prioridad cuando se manipula ganado. Las rutas de escape y los accesos alternativos en toda la instalación son cruciales tanto para los manipuladores como para el ganado. [41] Los lugares de almacenamiento y recolección de germoplasma deben incluir vestuarios para el personal, que proporcionen taquillas, duchas y almacenamiento de ropa y calzado, a fin de cumplir con los requisitos de saneamiento. [1]
El alojamiento de los animales es práctico para la recolección de germoplasma porque mantiene a los animales donantes en un área de fácil acceso, lo que hace que el proceso de recolección de germoplasma sea más fácil y eficiente. Las especies y razas de los animales alojados deben tenerse en cuenta al planificar la instalación; las instalaciones deben ser lo suficientemente grandes para cumplir con los estándares de bienestar animal, pero lo suficientemente pequeñas para reducir el contacto humano y aumentar la facilidad de manejo, al tiempo que se reduce el estrés del animal. Como el proceso de recolección de germoplasma puede llevar varios días, el animal puede estresarse y hacer que se obtenga una menor calidad del material genético. Por lo tanto, es fundamental entrenar al animal para que se familiarice con el proceso. [41] Las instalaciones de retención de animales también pueden servir como cuarentena. Las instalaciones de cuarentena son necesarias para prevenir la transmisión de enfermedades de un animal a otro, de un animal a germoplasma, de germoplasma a germoplasma y de germoplasma a animal. La introducción de la cuarentena para separar a los animales enfermos de los sanos debe realizarse de inmediato. Sin embargo, una cuarentena no siempre previene la propagación de enfermedades. [31]
El control de la temperatura y la ventilación deben incluirse en el diseño de las instalaciones de almacenamiento y recolección para mantener a los animales cómodos y saludables, al tiempo que se limita el estrés durante el proceso de recolección de germoplasma. La ventilación es una forma eficaz de mantener un flujo de aire limpio en todas las instalaciones y eliminar los olores. El control de la temperatura ayuda a regular la calidad del aire y el nivel de humedad dentro del establo. [1]
Un laboratorio de congelación y procesamiento de material genético puede estar en el mismo sitio que las instalaciones de almacenamiento y recolección. Sin embargo, el laboratorio debe tener estándares de saneamiento más altos. Según la FAO, un laboratorio de germoplasma adecuado debe incluir lo siguiente: [1]
La criopreservación requiere equipos para recolectar material biológico y tubos de ensayo para su almacenamiento. El precio varía mucho según la calidad de los materiales de recolección y almacenamiento. [42] La expectativa de vida de las herramientas debe considerarse al determinar los costos. [42] Además del equipo de laboratorio tradicional, la FAO también sugiere lo siguiente:
La crioconservación está limitada por las células y los tejidos que se pueden congelar y descongelar con éxito. Las células y los tejidos que se pueden congelar con éxito están limitados por su área de superficie. Para mantener viables las células y los tejidos, deben congelarse rápidamente para evitar la formación de cristales de hielo. Por lo tanto, una gran área de superficie es beneficiosa. [43] Otra limitación es la especie que se está preservando. Ha habido dificultades al utilizar métodos particulares de crioconservación con ciertas especies. Por ejemplo, la inseminación artificial es más difícil en ovejas que en vacas, cabras, cerdos o caballos debido a los pliegues posteriores en el cuello uterino de los ovinos. [13] La criopreservación de embriones depende de la especie y la etapa de desarrollo del embrión. Los embriones de cerdo son los más difíciles de congelar, descongelar y utilizar para producir crías vivas debido a su sensibilidad al frío y alto contenido de lípidos. [14]
La recolección y utilización de material genético requiere acuerdos claros entre las partes interesadas en lo que respecta a sus derechos y responsabilidades. [1] La FAO y otros, como Mendelsohn, sugieren que los gobiernos establezcan políticas con respecto a los recursos genéticos del ganado y su recolección, almacenamiento, distribución y utilización son responsabilidad de los gobiernos. [1] [9] La FAO también recomienda que las industrias ganaderas nacionales o regionales establezcan un comité asesor para asesorar y brindar recomendaciones sobre políticas. El ganado es tradicionalmente un bien privado; para obtener la propiedad de los materiales genéticos, los bancos de genes tienen varias estrategias que pueden implementar. [1] Los bancos de genes pueden:
Un ejemplo del uso de la crioconservación para prevenir la extinción de una raza de ganado es el caso del ganado gris húngaro , o Magyar Szürke. El ganado gris húngaro fue una vez una raza dominante en el sureste de Europa con una población de 4,9 millones de cabezas en 1884. Se utilizaban principalmente para fuerza de tiro y carne. Sin embargo, la población había disminuido a 280.000 cabezas al final de la Segunda Guerra Mundial y finalmente alcanzó la baja población de 187 hembras y 6 machos de 1965 a 1970. [4] La disminución del uso de la raza se debió principalmente a la mecanización de la agricultura y la adopción de razas principales, que producen una mayor producción de leche. [44] El gobierno húngaro lanzó un proyecto para preservar la raza, ya que posee rasgos valiosos, como resistencia, facilidad de parto, resistencia a las enfermedades y fácil adaptación a una variedad de climas. [4] [45] El programa gubernamental incluyó varias estrategias de conservación, incluida la criopreservación de semen y embriones. [4] Los esfuerzos de conservación del gobierno húngaro llevaron la población a 10.310 en 2012, lo que demuestra una mejora significativa mediante el uso de la crioconservación. [45]
El gaur , también conocido como bisonte indio, es el más pesado y poderoso de todos los bovinos salvajes nativos del sur y sudeste de Asia. [4] Los datos de campo indican que la población de animales maduros es de aproximadamente 5200 a 18 000. [46] Tanto el gaur macho como la hembra tienen jorobas distintivas entre la cabeza y los hombros, una cresta dorsal, cuernos prominentes y una papada que se extiende hasta las patas delanteras. El gaur crece un 60% más rápido que el ganado doméstico, lo que significa que los granjeros pueden cosechar carne a un ritmo más rápido, lo que hace que la producción de carne de vacuno sea dos o tres veces más rentable. La carne de gaur es preferida a la carne de otras razas entre la población local. Otro beneficio del bovino es que tiene la capacidad de sudar y tolera bien el calor. [47]
La población de gaur experimentó una disminución drástica de alrededor del 90% entre los años 1960 y 1990 debido a la caza furtiva, la caza comercial, la reducción del hábitat y la propagación de enfermedades. [48] [49] Según la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza, el gaur es una especie vulnerable debido a su población en declive en el sudeste asiático. [46] [48] Aunque la población mundial de gaur ha disminuido un 30% en los últimos 30 años, el gaur tiene una población relativamente estable en la India, debido a los esfuerzos de protección como la crioconservación. [46] La Asociación Estadounidense de Zoológicos y Acuarios , Integrated Conservation Research (ICR) y Advanced Cell Technology han realizado esfuerzos para utilizar especímenes criopreservados del gaur a través de inseminación artificial, transferencia de embriones y clonación, respectivamente. [4] [50] [47] La ICR ha logrado con éxito la hibridación con ganado doméstico, con el fin de crear ganado de mayor rendimiento y resistente al calor. [47]
La criopreservación también se emplea comúnmente en la investigación biomédica para archivar y distribuir ratones genéticamente modificados ( Mus musculus ). [38] Tanto los embriones preimplantacionales en varias etapas como los espermatozoides se pueden utilizar para este propósito. Para la distribución, las muestras criopreservadas se transportan típicamente utilizando un transportador seco . [51] Entre los dos métodos, la criopreservación de espermatozoides ofrece claras ventajas: es más rentable y requiere menos animales de experimentación que la criopreservación de embriones. [52]