La clorofila es uno de varios pigmentos verdes relacionados que se encuentran en las cianobacterias y en los cloroplastos de las algas y las plantas . [2] Su nombre se deriva de las palabras griegas χλωρός , khloros ("verde pálido") y φύλλον , phyllon ("hoja"). [3] La clorofila permite a las plantas absorber energía de la luz.
Las clorofilas absorben la luz con mayor intensidad en la porción azul del espectro electromagnético , así como en la porción roja. [4] Por el contrario, absorben mal las porciones verde y casi verde del espectro. Por lo tanto, los tejidos que contienen clorofila se ven verdes porque la luz verde, reflejada de manera difusa por estructuras como las paredes celulares, se absorbe menos. [1] Existen dos tipos de clorofila en los fotosistemas de las plantas verdes: clorofila a y b . [5]
La clorofila fue aislada y nombrada por primera vez por Joseph Bienaimé Caventou y Pierre Joseph Pelletier en 1817. [6] La presencia de magnesio en la clorofila fue descubierta en 1906, [7] y fue la primera detección de ese elemento en tejido vivo. [8]
Después del trabajo inicial realizado por el químico alemán Richard Willstätter entre 1905 y 1915, la estructura general de la clorofila a fue dilucidada por Hans Fischer en 1940. En 1960, cuando se conocía la mayor parte de la estereoquímica de la clorofila a , Robert Burns Woodward publicó una síntesis total de la molécula. [8] [9] En 1967, la última elucidación estereoquímica restante fue completada por Ian Fleming , [10] y en 1990 Woodward y coautores publicaron una síntesis actualizada. [11] Se anunció que la clorofila f estaba presente en cianobacterias y otros microorganismos oxigenados que forman estromatolitos en 2010; [12] [13] Se dedujo una fórmula molecular de C 55 H 70 O 6 N 4 Mg y una estructura de (2- formil )-clorofila a basándose en espectros de RMN, ópticos y de masas. [14]

La clorofila es vital para la fotosíntesis , que permite a las plantas absorber energía de la luz . [15]
Las moléculas de clorofila están dispuestas dentro y alrededor de fotosistemas que están incrustados en las membranas tilacoides de los cloroplastos . [16] En estos complejos, la clorofila cumple tres funciones:
Las dos unidades de fotosistemas aceptadas actualmente son el fotosistema I y el fotosistema II , que tienen sus propios centros de reacción distintos, denominados P700 y P680 , respectivamente. Estos centros reciben su nombre de la longitud de onda (en nanómetros ) de su pico rojo máximo de absorción. La identidad, la función y las propiedades espectrales de los tipos de clorofila en cada fotosistema son distintas y están determinadas entre sí y por la estructura proteica que los rodea.
La función del centro de reacción de la clorofila es absorber la energía luminosa y transferirla a otras partes del fotosistema. La energía absorbida del fotón se transfiere a un electrón en un proceso llamado separación de carga. La eliminación del electrón de la clorofila es una reacción de oxidación. La clorofila dona el electrón de alta energía a una serie de intermediarios moleculares llamados cadena de transporte de electrones . El centro de reacción cargado de la clorofila (P680 + ) se reduce luego de nuevo a su estado fundamental al aceptar un electrón despojado del agua. El electrón que reduce P680 + proviene en última instancia de la oxidación del agua en O2 y H + a través de varios intermediarios. Esta reacción es la forma en que los organismos fotosintéticos como las plantas producen gas O2 , y es la fuente de prácticamente todo el O2 en la atmósfera de la Tierra. El fotosistema I normalmente funciona en serie con el fotosistema II; por lo tanto, el P700 + del fotosistema I suele reducirse a medida que acepta el electrón, a través de muchos intermediarios en la membrana tilacoide, por electrones que provienen, en última instancia, del fotosistema II. Sin embargo, las reacciones de transferencia de electrones en las membranas tilacoides son complejas y la fuente de electrones utilizada para reducir P700 + puede variar.
El flujo de electrones producido por los pigmentos de clorofila del centro de reacción se utiliza para bombear iones H + a través de la membrana tilacoide, lo que establece una fuerza protón-motriz, un potencial quimiosmótico utilizado principalmente en la producción de ATP (energía química almacenada) o para reducir NADP + a NADPH . El NADPH es un agente universal utilizado para reducir el CO2 en azúcares, así como en otras reacciones biosintéticas.
Los complejos de clorofila-proteína del centro de reacción son capaces de absorber directamente la luz y llevar a cabo eventos de separación de carga sin la ayuda de otros pigmentos de clorofila, pero la probabilidad de que eso ocurra bajo una intensidad de luz dada es pequeña. Por lo tanto, las otras clorofilas en el fotosistema y las proteínas de pigmento de antena absorben y canalizan cooperativamente la energía de la luz hacia el centro de reacción. Además de la clorofila a , hay otros pigmentos, llamados pigmentos accesorios , que se encuentran en estos complejos de pigmento-proteína de antena.
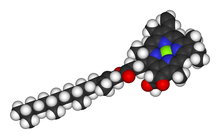
Se conocen varias clorofilas. Todas se definen como derivados de la clorina progenitora por la presencia de un quinto anillo que contiene cetona más allá de los cuatro anillos similares al pirrol. La mayoría de las clorofilas se clasifican como clorinas , que son parientes reducidos de las porfirinas (que se encuentran en la hemoglobina ). Comparten una vía biosintética común con las porfirinas, incluido el precursor uroporfirinógeno III . A diferencia de los hemo, que contienen hierro unido al centro N4, la mayoría de las clorofilas se unen al magnesio . Los ligandos axiales unidos al centro Mg 2+ a menudo se omiten para mayor claridad. Anexas al anillo de clorina hay varias cadenas laterales, que generalmente incluyen una larga cadena de fitilo ( C 20 H 39 O ). La forma más ampliamente distribuida en las plantas terrestres es la clorofila a . La única diferencia entre la clorofila a y la clorofila b es que la primera tiene un grupo metilo mientras que la segunda tiene un grupo formilo . Esta diferencia provoca una diferencia considerable en el espectro de absorción, permitiendo que las plantas absorban una mayor porción de luz visible.
Las estructuras de las clorofilas se resumen a continuación: [17] [18]
La clorofila e se reserva para un pigmento que se extrajo de algas en 1966 pero que no se describió químicamente. Además de las clorofilas con letras, se conocen en la naturaleza una amplia variedad de modificaciones de la cadena lateral de las estructuras de la clorofila. Por ejemplo, Prochlorococcus , una cianobacteria, utiliza 8-vinil Chl a y b . [19]

Las clorofilas se pueden extraer de la proteína en solventes orgánicos. [20] [21] [22] De esta manera, se puede estimar la concentración de clorofila dentro de una hoja. [23] También existen métodos para separar la clorofila a y la clorofila b .
En el éter dietílico , la clorofila a tiene máximos de absorbancia aproximados de 430 nm y 662 nm, mientras que la clorofila b tiene máximos aproximados de 453 nm y 642 nm. [24] Los picos de absorción de la clorofila a están a 465 nm y 665 nm. La clorofila a fluoresce a 673 nm (máximo) y 726 nm. El coeficiente de absorción molar máximo de la clorofila a supera los 10 5 M −1 cm −1 , que se encuentra entre los más altos para compuestos orgánicos de moléculas pequeñas. [25] En acetona-agua al 90%, las longitudes de onda de absorción máxima de la clorofila a son 430 nm y 664 nm; los picos de la clorofila b son 460 nm y 647 nm; los picos de la clorofila c 1 son 442 nm y 630 nm; Los picos para la clorofila c 2 son 444 nm y 630 nm; los picos para la clorofila d son 401 nm, 455 nm y 696 nm. [26]
La emisión de fluorescencia de proporción se puede utilizar para medir el contenido de clorofila. Al excitar la fluorescencia de la clorofila a una longitud de onda más baja, la proporción de emisión de fluorescencia de clorofila a705 ± 10 nm y735 ± 10 nm puede proporcionar una relación lineal del contenido de clorofila en comparación con las pruebas químicas. La relación F 735 / F 700 proporcionó un valor de correlación de r 2 de 0,96 en comparación con las pruebas químicas en el rango de 41 mg m −2 hasta 675 mg m −2 . Gitelson también desarrolló una fórmula para la lectura directa del contenido de clorofila en mg m −2 . La fórmula proporcionó un método confiable para medir el contenido de clorofila desde 41 mg m −2 hasta 675 mg m −2 con un valor de correlación r 2 de 0,95. [27]
El Dualex es un sensor óptico que se utiliza en la ciencia vegetal y la agricultura para evaluar el contenido de clorofila en las hojas. Este dispositivo permite a los investigadores realizar mediciones en tiempo real y no destructivas. [28]
En algunas plantas, la clorofila se deriva del glutamato y se sintetiza a lo largo de una vía biosintética ramificada que se comparte con el hemo y el sirohemo . [29] [30] [31] La clorofila sintasa [32] es la enzima que completa la biosíntesis de la clorofila a : [33] [34]
Esta conversión forma un éster del grupo de ácido carboxílico en la clorofilida a con el alcohol diterpénico de 20 carbonos fitol . La clorofila b es producida por la misma enzima que actúa sobre la clorofilida b . Lo mismo se sabe de la clorofila d y f , ambas producidas a partir de clorofilidas correspondientes, que finalmente se obtienen a partir de la clorofilida a . [35]
En las plantas angiospermas , los pasos posteriores de la vía biosintética dependen de la luz. Estas plantas son pálidas ( etioladas ) si crecen en la oscuridad. Las plantas no vasculares y las algas verdes tienen una enzima adicional independiente de la luz y crecen verdes incluso en la oscuridad. [36]
La clorofila se encuentra ligada a proteínas . La protoclorofilida , uno de los intermediarios biosintéticos, se encuentra mayoritariamente en forma libre y, en condiciones de luz, actúa como fotosensibilizador , formando radicales libres , que pueden ser tóxicos para la planta. Por lo tanto, las plantas regulan la cantidad de este precursor de la clorofila. En las angiospermas, esta regulación se logra en el paso del ácido aminolevulínico (ALA), uno de los compuestos intermedios en la vía de biosíntesis. Las plantas que se alimentan de ALA acumulan niveles altos y tóxicos de protoclorofilida; lo mismo ocurre con los mutantes con un sistema regulador dañado. [37]
El proceso de senescencia de las plantas implica la degradación de la clorofila: por ejemplo, la enzima clorofilasa ( EC 3.1.1.14) hidroliza la cadena lateral de fitilo para revertir la reacción en la que las clorofilas se biosintetizan a partir de clorofilida a o b . Dado que la clorofilida a se puede convertir en clorofilida b y esta última se puede reesterificar a clorofila b , estos procesos permiten el ciclo entre las clorofilas a y b . Además, la clorofila b se puede reducir directamente (a través de 7 1 -hidroxiclorofila a ) de nuevo a clorofila a , completando el ciclo. [38] [39] En etapas posteriores de la senescencia, las clorofilidas se convierten en un grupo de tetrapirroles incoloros conocidos como catabolitos de clorofila no fluorescentes (NCC) con la estructura general:
Estos compuestos también se han identificado en frutos maduros y dan colores otoñales característicos a las plantas de hoja caduca . [39] [40]
Los mapas de clorofila muestran miligramos de clorofila por metro cúbico de agua de mar cada mes. Los lugares donde las cantidades de clorofila eran muy bajas, lo que indicaba una cantidad muy baja de fitoplancton , están en azul. Los lugares donde las concentraciones de clorofila eran altas, lo que significa que crecía mucho fitoplancton, están en amarillo. Las observaciones provienen del espectrorradiómetro de imágenes de resolución moderada (MODIS) en el satélite Aqua de la NASA. La tierra es gris oscuro y los lugares donde MODIS no pudo recopilar datos debido al hielo marino, la oscuridad polar o las nubes son gris claro. Las concentraciones más altas de clorofila, donde prosperan las pequeñas plantas oceánicas que viven en la superficie , se encuentran en aguas polares frías o en lugares donde las corrientes oceánicas traen agua fría a la superficie, como alrededor del ecuador y a lo largo de las costas de los continentes. No es el agua fría en sí la que estimula el fitoplancton. En cambio, las temperaturas frías suelen ser una señal de que el agua ha subido a la superficie desde las profundidades del océano, transportando nutrientes que se han acumulado con el tiempo. En las aguas polares, los nutrientes se acumulan en las aguas superficiales durante los meses oscuros del invierno, cuando las plantas no pueden crecer. Cuando la luz del sol regresa en primavera y verano, las plantas florecen en altas concentraciones. [41]
La clorofila sintética está registrada como colorante alimentario y su número E es E140 . Los chefs utilizan la clorofila para dar color verde a una variedad de alimentos y bebidas, como la pasta y los licores. La absenta obtiene su color verde de forma natural a partir de la clorofila que se introduce a través de la gran variedad de hierbas que se utilizan en su producción. [42] La clorofila no es soluble en agua y primero se mezcla con una pequeña cantidad de aceite vegetal para obtener la solución deseada . [ cita requerida ]
Un estudio de 2002 descubrió que "las hojas expuestas a una luz intensa contenían proteínas de antena mayores degradadas , a diferencia de las que se mantuvieron en la oscuridad, lo que es coherente con los estudios sobre la iluminación de proteínas aisladas ". Esto pareció a los autores como un apoyo a la hipótesis de que " las especies activas de oxígeno desempeñan un papel in vivo " en el comportamiento a corto plazo de las plantas. [43]
De la pág. 49:
"Das Hauptproduct der alkalischen Hydrolyse bilden tiefgrüne Alkalisalze. In ihnen liegen complexe Magnesiumverbindungen vor, die das Metall in einer gegen Alkali auch bei hoher Temperatur merkwürdigwidestandsfähigen Bindung enthalten."
(Las sales alcalinas de color verde intenso forman el principal producto de la hidrólisis alcalina. En ellas están presentes compuestos complejos de magnesio, que contienen el metal en un enlace extraordinariamente resistente a los álcalis incluso a altas temperaturas.)
{{cite book}}: |website=ignorado ( ayuda )