Un clatrato es una sustancia química que consiste en una red que atrapa o contiene moléculas. La palabra clatrato se deriva del latín clathratus ( clatratus ), que significa "con barras, enrejado ". [1] La mayoría de los compuestos de clatrato son poliméricos y envuelven completamente la molécula huésped, pero en el uso moderno los clatratos también incluyen complejos huésped-huésped y compuestos de inclusión . [2] Según la IUPAC , los clatratos son compuestos de inclusión "en los que la molécula huésped está en una jaula formada por la molécula huésped o por una red de moléculas huésped". [3] El término se refiere a muchos huéspedes moleculares, incluidos los calixarenos y las ciclodextrinas e incluso algunos polímeros inorgánicos como las zeolitas .
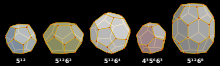
Los clatratos se pueden dividir en dos categorías: hidratos de clatrato y clatratos inorgánicos. Cada clatrato se compone de un marco y huéspedes que residen en el marco. Las estructuras cristalinas de clatrato más comunes pueden estar compuestas de cavidades como las cavidades dodecaédrica , tetracaidecaédrica y hexacaidecaédrica .
La fracción molar de agua de la mayoría de los hidratos de clatrato es del 85%. Los hidratos de clatrato se derivan de estructuras orgánicas unidas por enlaces de hidrógeno . Estos marcos se preparan a partir de moléculas que se "autoasocian" mediante múltiples interacciones de enlaces de hidrógeno. Pequeñas moléculas o gases (es decir, metano, dióxido de carbono, hidrógeno) pueden quedar encerrados como invitados en los hidratos. La proporción huésped/huésped ideal para los hidratos de clatrato oscila entre 0,8 y 0,9. La interacción del huésped con el anfitrión se limita a las fuerzas de Van der Waals . Existen ciertas excepciones en los semiclatratos donde los huéspedes se incorporan a la estructura del anfitrión a través de enlaces de hidrógeno con la estructura del anfitrión. Los hidratos se forman a menudo con el llenado parcial de los invitados y colapsan en ausencia de invitados que ocupan las jaulas de agua. Al igual que el hielo, los hidratos de clatrato son estables a bajas temperaturas y alta presión y poseen propiedades similares a la resistividad eléctrica. Los hidratos de clatrato se producen de forma natural y se pueden encontrar en el permafrost y los sedimentos oceánicos. Los hidratos también se pueden sintetizar mediante cristalización de semillas o utilizando precursores amorfos para la nucleación. [4]
A diferencia de los hidratos, los clatratos inorgánicos tienen una estructura de átomos inorgánicos unidos covalentemente con huéspedes que generalmente consisten en metales alcalinos o alcalinotérreos . Debido al enlace covalente más fuerte, las jaulas suelen ser más pequeñas que los hidratos. Los átomos huéspedes interactúan con el huésped mediante enlaces iónicos o covalentes. Por lo tanto, la sustitución parcial de los átomos huéspedes sigue las reglas de Zintl de modo que se conserva la carga del compuesto general. La mayoría de los clatratos inorgánicos tienen la ocupación total de sus jaulas estructurales por un átomo huésped para estar en fase estable. Los clatratos inorgánicos se pueden sintetizar mediante reacción directa utilizando molinos de bolas a altas temperaturas o altas presiones. Cristalización a partir de masa fundida en otra ruta de síntesis común. Debido a la gran variedad de composición de las especies huésped y huésped, los clatratos inorgánicos son mucho más diversos químicamente y poseen una amplia gama de propiedades. En particular, se puede encontrar que los clatratos inorgánicos son tanto aislantes como superconductores (Ba 8 Si 46 ). Una propiedad común de los clatratos inorgánicos que ha atraído a los investigadores es la baja conductividad térmica . La baja conductividad térmica se atribuye a la capacidad del átomo huésped de "traquetear" dentro de la estructura del huésped. La libertad de movimiento de los átomos huéspedes dispersa los fonones que transportan calor. [4]


Los clatratos se han explorado para muchas aplicaciones, entre ellas: almacenamiento de gas, producción de gas, separación de gas, desalinización , termoeléctrica , fotovoltaica y baterías.
2CCl4.jpg/440px-Cd(CN)2CCl4.jpg)

Los hidratos de clatrato fueron descubiertos en 1810 por Humphry Davy . [9] Los clatratos fueron estudiados por P. Pfeiffer en 1927 y en 1930, E. Hertel definió los "compuestos moleculares" como sustancias descompuestas en componentes individuales siguiendo la ley de acción de masas en estado de solución o gas. Hammerschmidt descubrió en 1934 que los hidratos de clatrato formaban obstrucciones en los gasoductos, lo que llevó a un aumento en la investigación para evitar la formación de hidratos. [10] En 1945, HM Powell analizó la estructura cristalina de estos compuestos y los denominó clatratos . Desde entonces se ha realizado la producción de gas a través de hidratos de metano y se ha probado para la producción de energía en Japón y China. [4]
Los compuestos de inclusión suelen ser moléculas, mientras que los clatratos suelen ser poliméricos [ cita necesaria ] . Los compuestos de intercalación no son tridimensionales, a diferencia de los compuestos de clatrato. Se han examinado compuestos enjaulados fotolíticamente sensibles como contenedores para liberar un fármaco o reactivo . [11]
Las zeolitas son otro tipo de estructuras cristalinas que forman un entramado con cavidades en las que pueden residir especies huéspedes. A diferencia de los clatratos, las zeolitas se definen por la unión tetraédrica de cuatro átomos de oxígeno que rodean un catión. [ cita necesaria ] Los invitados tampoco están obligados a llenar las cavidades abiertas. Las estructuras de zeolita están definidas por las diversas unidades constructivas de la estructura, a diferencia de las estructuras de cavidades en los clatratos. Se han explorado aplicaciones similares.
El clatrasil de sílice son compuestos estructuralmente similares a los hidratos de clatrato con una estructura de SiO 2 y se pueden encontrar en una variedad de sedimentos marinos. [12]