Un cromosoma circular es un cromosoma en bacterias , arqueas , mitocondrias y cloroplastos , en forma de una molécula de ADN circular, a diferencia del cromosoma lineal de la mayoría de los eucariotas .
La mayoría de los cromosomas procariotas contienen una molécula de ADN circular. Esto tiene la gran ventaja de no tener extremos libres ( telómeros ) en el ADN . Por el contrario, la mayoría de los eucariotas tienen ADN lineal que requiere mecanismos elaborados para mantener la estabilidad de los telómeros y replicar el ADN . Sin embargo, un cromosoma circular tiene la desventaja de que después de la replicación, los dos cromosomas circulares de la progenie pueden permanecer interconectados o enredados, y deben separarse para que cada célula herede una copia completa del cromosoma durante la división celular .

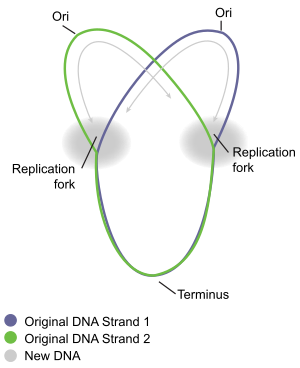
La replicación cromosómica circular de las bacterias se entiende mejor en las bacterias bien estudiadas Escherichia coli y Bacillus subtilis . La replicación cromosómica se produce en tres etapas principales: iniciación, elongación y terminación. La etapa de iniciación comienza con el ensamblaje ordenado de proteínas "iniciadoras" en la región de origen del cromosoma, llamada oriC . Estas etapas de ensamblaje están reguladas para garantizar que la replicación cromosómica ocurra solo una vez en cada ciclo celular. Durante la fase de elongación de la replicación, las enzimas que se ensamblaron en oriC durante la iniciación avanzan a lo largo de cada brazo ( replicoro ) del cromosoma, en direcciones opuestas alejándose del oriC, replicando el ADN para crear dos copias idénticas. Este proceso se conoce como replicación bidireccional. El conjunto completo de moléculas involucradas en la replicación del ADN en cada brazo se llama replisoma . En la vanguardia del replisoma hay una helicasa de ADN que desenrolla las dos hebras de ADN, creando una horquilla de replicación móvil . Las dos hebras simples de ADN desenrolladas sirven como plantillas para la ADN polimerasa , que se mueve con la helicasa (junto con otras proteínas) para sintetizar una copia complementaria de cada hebra. De esta manera, se crean dos copias idénticas del ADN original. Finalmente, las dos horquillas de replicación que se mueven alrededor del cromosoma circular se encuentran en una zona específica del cromosoma, aproximadamente opuesta a oriC, llamada región terminal. Luego, las enzimas de elongación se desensamblan y los dos cromosomas "hijos" se resuelven antes de que se complete la división celular.

El origen de replicación de E. coli , llamado oriC , consiste en secuencias de ADN que son reconocidas por la proteína DnaA , que está altamente conservada entre las diferentes especies bacterianas . La unión de DnaA al origen inicia el reclutamiento regulado de otras enzimas y proteínas que eventualmente conducirán al establecimiento de dos replisomas completos para la replicación bidireccional. [1]
Los elementos de la secuencia de ADN dentro de oriC que son importantes para su función incluyen cajas DnaA, una repetición de 9 meros con una secuencia de consenso altamente conservada 5' – TTATCCACA – 3', [2] que son reconocidas por la proteína DnaA. La proteína DnaA juega un papel crucial en el inicio de la replicación del ADN cromosómico. [3] Unida al ATP, y con la ayuda de proteínas bacterianas similares a histonas [HU], DnaA luego desenrolla una región rica en AT cerca del límite izquierdo de oriC , que lleva tres motivos de 13 meros, [4] y abre el ADN bicatenario para la entrada de otras proteínas de replicación. [5]
Esta región también contiene cuatro secuencias de elementos de desenrollado de ADN “GATC” que son reconocidas por la ADN adenina metilasa (Dam), una enzima que modifica la base de adenina cuando esta secuencia no está metilada o está hemimetilada. La metilación de las adeninas es importante ya que altera la conformación del ADN para promover la separación de las cadenas, [6] y parece que esta región de ori C tiene una tendencia natural a desenrollarse. [7]
Luego, DnaA recluta la helicasa replicativa , DnaB , del complejo DnaB-DnaC a la región desenrollada para formar el complejo de precebado. [8] Después de que DnaB se transloca al vértice de cada horquilla de replicación, la helicasa desenrolla el ADN parental e interactúa momentáneamente con la primasa . [9]
Para que la replicación del ADN continúe, se necesitan proteínas de unión monocatenarias para evitar que las cadenas simples de ADN formen estructuras secundarias y que se vuelvan a unir . Además, se necesita la ADN girasa para aliviar el estrés topológico creado por la acción de la helicasa DnaB.
Cuando la horquilla de replicación se mueve alrededor del círculo, se forma una estructura con la forma de la letra griega theta Ҩ. John Cairns demostró la estructura theta de la replicación cromosómica de E. coli en 1963, utilizando un método innovador para visualizar la replicación del ADN. En su experimento, marcó radiactivamente el cromosoma haciendo crecer sus cultivos en un medio que contenía 3H- timidina . La base nucleósida se incorporó uniformemente al cromosoma bacteriano. Luego aisló los cromosomas lisando las células suavemente y las colocó en una rejilla de micrografía electrónica (EM) que expuso a una película de rayos X durante dos meses. Este experimento demuestra claramente el modelo de replicación theta de los cromosomas bacterianos circulares. [10]
Como se ha descrito anteriormente, la replicación cromosómica bacteriana se produce de forma bidireccional. Esto se demostró por primera vez marcando específicamente los cromosomas bacterianos replicantes con isótopos radiactivos . Las regiones de ADN que se replicaban durante el experimento se visualizaron a continuación mediante autorradiografía y examinando la película revelada al microscopio. Esto permitió a los investigadores ver dónde se estaba produciendo la replicación. Las primeras observaciones concluyentes de la replicación bidireccional se obtuvieron a partir de estudios de B. subtilis. [11] Poco después, también se demostró que el cromosoma de E. coli se replicaba de forma bidireccional. [12]
La holoenzima ADN polimerasa III de E. coli es un complejo de 900 kD, que posee una estructura esencialmente dimérica . Cada unidad monomérica tiene un núcleo catalítico, una subunidad de dimerización y un componente de procesividad . [13] La ADN Pol III utiliza un conjunto de sus subunidades centrales para sintetizar la cadena líder de forma continua, mientras que el otro conjunto de subunidades centrales realiza ciclos de un fragmento de Okazaki al siguiente en la cadena rezagada en bucle. La síntesis de la cadena líder comienza con la síntesis de un cebador de ARN corto en el origen de replicación por la enzima Primasa ( proteína DnaG ).
A continuación, se añaden desoxirribonucleótidos a este cebador mediante un único dímero de la ADN polimerasa III, en un complejo integrado con la helicasa DnaB. A continuación, la síntesis de la cadena líder se lleva a cabo de forma continua, mientras que el ADN se desenrolla simultáneamente en la horquilla de replicación. Por el contrario, la síntesis de la cadena rezagada se lleva a cabo en fragmentos cortos de Okazaki. En primer lugar, la primasa sintetiza un cebador de ARN y, al igual que en la síntesis de la cadena líder, la ADN Pol III se une al cebador de ARN y añade desoxirribonucleótidos .
Cuando se ha completado la síntesis de un fragmento de Okazaki, la replicación se detiene y las subunidades centrales de la ADN Pol III se disocian de la abrazadera deslizante β [la abrazadera deslizante B es la subunidad de procesividad de la ADN Pol III]. [14] El cebador de ARN se elimina y se reemplaza con ADN por la ADN polimerasa I [que también posee actividad exonucleasa de corrección de pruebas ] y la muesca restante es sellada por la ADN ligasa , que luego liga estos fragmentos para formar la cadena rezagada.
Una proporción sustancial (10-15%) de las horquillas de replicación que se originan en oriC encuentran un daño en el ADN o una rotura de cadena cuando las células se cultivan en condiciones normales de laboratorio (sin un tratamiento exógeno que dañe el ADN). [15] Los daños en el ADN encontrados son procesados normalmente por enzimas de reparación recombinatoria para permitir la progresión continua de la horquilla de replicación. [15]

La terminación es el proceso de fusión de las horquillas de replicación y desensamblaje de los replisomas para producir dos moléculas de ADN separadas y completas . Ocurre en la región terminal, aproximadamente opuesta a oriC en el cromosoma (Fig. 5). La región terminal contiene varios sitios de terminación de la replicación del ADN, o sitios "Ter". Una proteína "terminadora de la replicación" especial debe estar unida al sitio Ter para que pause la replicación. Cada sitio Ter tiene polaridad de acción, es decir, detendrá una horquilla de replicación que se acerque al sitio Ter desde una dirección, pero permitirá el movimiento sin impedimentos de la horquilla a través del sitio Ter desde la otra dirección. La disposición de los sitios Ter forma dos grupos opuestos que obligan a las dos horquillas a encontrarse entre sí dentro de la región que abarcan. Esta disposición se llama "trampa de la horquilla de replicación". [16]
Los sitios Ter interactúan específicamente con la proteína terminadora de replicación llamada Tus en E. coli . [17] El complejo Tus-Ter impide la actividad de desenrollado del ADN de DnaB de una manera dependiente de la orientación. [18]
La replicación del ADN que separa las horquillas de replicación opuestas deja los cromosomas completos unidos como " catenanos " o círculos interconectados topológicamente. Los círculos no están unidos covalentemente sino mecánicamente, porque están entrelazados y cada uno está cerrado covalentemente. Los círculos encadenados requieren la acción de las topoisomerasas para separar los círculos (decatenación). En E. coli , la topoisomerasa IV del ADN desempeña el papel principal en la separación de los cromosomas encadenados, rompiendo transitoriamente ambas cadenas de ADN de un cromosoma y permitiendo que el otro cromosoma pase a través de la ruptura.
Ha habido cierta confusión sobre el papel que desempeña la ADN girasa en la decatenación. Para definir la nomenclatura, existen dos tipos de topoisomerasas: el tipo I produce roturas transitorias de cadena sencilla en el ADN y el tipo II produce roturas transitorias de cadena doble. Como resultado, la enzima tipo I elimina las superenrollaciones del ADN una a la vez, mientras que la enzima tipo II elimina las superenrollaciones de dos en dos. La topo I de procariotas y eucariotas es la topoisomerasa tipo I. La topo II eucariota, la girasa bacteriana y la topo IV bacteriana pertenecen al tipo II.
La ADN girasa también tiene actividad de topoisomerasa tipo II; por lo tanto, al ser un homólogo de la topoisomerasa IV (que también tiene actividad de topoisomerasa II), esperamos similitud en las funciones de las dos proteínas. El papel preliminar de la ADN girasa es introducir superenrollamientos negativos en el ADN, relajando así los superenrollamientos positivos que se forman durante la replicación del ADN. La topoisomerasa IV también relaja los superenrollamientos positivos, por lo tanto, la ADN girasa y la topoisomerasa IV desempeñan un papel casi idéntico en la eliminación de los superenrollamientos positivos antes de que una ADN polimerasa transloque, lo que permite que la replicación del ADN continúe sin obstáculos por la tensión topológica. [19]
La ADN girasa no es la única enzima responsable de la decatenación. En un experimento de Zechiedrich , Khodursky y Cozzarelli en 1997, se encontró que la topoisomerasa IV es la única decatenasa importante de intermediarios de replicación de ADN en bacterias. [20] Cuando se inhibió la ADN girasa sola, la mayoría de los catenanos se desvincularon. Sin embargo, cuando se inhibió la topoisomerasa IV sola, la decatenación se bloqueó casi por completo. Esto sugiere que la topoisomerasa IV es la proteína primaria para la decatenación de cromosomas interconectados in vivo , y que la ADN girasa desempeña un papel menor.
Varios grupos de bacterias, incluidas Brucella , Paracoccus denitrificans y Vibrio , tienen múltiples cromosomas circulares.
Este artículo se basa en un artículo de Imalda Devaparanam y David Tribe publicado bajo las condiciones de licencia CC by SA a partir de una actividad de curso universitario en el Departamento de Microbiología e Inmunología, Universidad de Melbourne, 2007. [ cita requerida ] Este artículo incorpora material del artículo de Citizendium "Replicación de un cromosoma bacteriano circular", que se encuentra bajo la licencia Creative Commons Attribution-ShareAlike 3.0 Unported pero no bajo la GFDL .