La catálisis fotorredox es una rama de la fotoquímica que utiliza la transferencia de un solo electrón . Los catalizadores fotorredox generalmente se obtienen de tres clases de materiales: complejos de metales de transición, colorantes orgánicos y semiconductores . Si bien los catalizadores fotorredox orgánicos fueron dominantes durante la década de 1990 y principios de la década de 2000, [1] los complejos solubles de metales de transición se utilizan con más frecuencia en la actualidad.
Los sensibilizadores absorben la luz para dar estados excitados redox-activos. Para muchos sensibilizadores basados en metales, la excitación se realiza como una transferencia de carga de metal a ligando , por la cual un electrón se mueve desde el metal (por ejemplo, orbital d) a un orbital localizado en los ligandos (por ejemplo, el orbital π* de un ligando aromático). Este estado electrónico excitado inicial se relaja a un estado excitado singlete a través de una conversión interna , un proceso donde la energía se disipa como energía vibracional (calor) en lugar de como radiación electromagnética. Este estado excitado singlete puede relajarse aún más mediante dos procesos distintos: el catalizador puede fluorescer , irradiando un fotón y volviendo al estado fundamental singlete original, o puede moverse al estado excitado triplete de energía más baja (un estado donde dos electrones desapareados tienen el mismo espín) mediante un segundo proceso no radiativo denominado cruce entre sistemas .
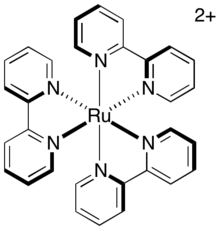
La relajación directa del triplete excitado al estado fundamental, denominada fosforescencia , requiere tanto la emisión de un fotón como la inversión del espín del electrón excitado. Esta vía es lenta porque está prohibida por el espín , por lo que el estado excitado del triplete tiene una vida media sustancial. Para el fotosensibilizador común, tris-(2,2'-bipiridil)rutenio (abreviado como [Ru(bipy) 3 ] 2+ o [Ru(bpy) 3 ] 2+ ), la vida media del estado excitado del triplete es de aproximadamente 1100 ns. Esta vida media es suficiente para que se produzcan otras vías de relajación (específicamente, vías de transferencia de electrones) antes de la desintegración del catalizador a su estado fundamental.

El estado excitado de triplete de larga duración al que se puede acceder mediante fotoexcitación es a la vez un agente reductor y oxidante más potente que el estado fundamental del catalizador. Dado que el sensibilizador está saturado de manera coordinada, la transferencia de electrones debe ocurrir mediante un proceso de esfera externa , en el que el electrón se desplaza por un túnel entre el catalizador y el sustrato.
La teoría de Marcus sobre la transferencia de electrones en la esfera exterior predice que dicho proceso de tunelización ocurrirá más rápidamente en sistemas donde la transferencia de electrones es termodinámicamente favorable (es decir, entre reductores y oxidantes fuertes) y donde la transferencia de electrones tiene una barrera intrínseca baja.
La barrera intrínseca de la transferencia de electrones se deriva del principio de Franck-Condon , que establece que la transición electrónica se produce más rápidamente cuanto mayor es la superposición entre los estados electrónicos inicial y final. Interpretado libremente, este principio sugiere que la barrera de una transición electrónica está relacionada con el grado en que el sistema intenta reorganizarse. En el caso de una transición electrónica con un sistema, la barrera está relacionada con la "superposición" entre las funciones de onda inicial y final del electrón excitado, es decir, el grado en que el electrón necesita "moverse" en la transición.
En una transferencia de electrones intermolecular, un papel similar lo desempeña el grado en que los núcleos intentan moverse en respuesta al cambio en su nuevo entorno electrónico. Inmediatamente después de la transferencia de electrones, la disposición nuclear de la molécula, previamente en equilibrio, ahora representa un estado vibracionalmente excitado y debe relajarse a su nueva geometría de equilibrio. Los sistemas rígidos, cuya geometría no depende en gran medida del estado de oxidación, experimentan por lo tanto menos excitación vibracional durante la transferencia de electrones y tienen una barrera intrínseca más baja. Los fotocatalizadores como [Ru(bipy) 3 ] 2+ , se mantienen en una disposición rígida mediante ligandos bidentados planos dispuestos en una geometría octaédrica alrededor del centro metálico. Por lo tanto, el complejo no sufre mucha reorganización durante la transferencia de electrones. Dado que la transferencia de electrones de estos complejos es rápida, es probable que tenga lugar dentro de la duración del estado activo del catalizador, es decir, durante la vida útil del estado excitado triplete.

Para regenerar el estado fundamental, el catalizador debe participar en una segunda transferencia de electrones a la esfera exterior. En muchos casos, esta transferencia de electrones se lleva a cabo con un reductor u oxidante estequiométrico de dos electrones, aunque en algunos casos este paso implica un segundo reactivo.
Dado que el paso de transferencia de electrones del ciclo catalítico se lleva a cabo desde el estado excitado triplete, compite con la fosforescencia como vía de relajación. Los experimentos de Stern-Volmer miden la intensidad de la fosforescencia mientras se varía la concentración de cada posible agente extintor. Cuando se varía la concentración del agente extintor real, se afecta la velocidad de transferencia de electrones y el grado de fosforescencia. Esta relación se modela mediante la ecuación:
Aquí, I e I 0 denotan la intensidad de emisión con y sin agente de extinción presente, k q la constante de velocidad del proceso de extinción, τ 0 la vida útil del estado excitado en ausencia de agente de extinción y [Q] la concentración de agente de extinción. Por lo tanto, si la vida útil del estado excitado del catalizador fotorredox se conoce a partir de otros experimentos, la constante de velocidad de extinción en presencia de un solo componente de reacción se puede determinar midiendo el cambio en la intensidad de emisión a medida que cambia la concentración de agente de extinción.
Los potenciales redox de los catalizadores fotorredox deben coincidir con los de los demás componentes de la reacción. Si bien los potenciales redox del estado fundamental se miden fácilmente mediante voltametría cíclica u otros métodos electroquímicos, la medición del potencial redox de un estado excitado electrónicamente no se puede lograr directamente mediante estos métodos. [2] Sin embargo, existen dos métodos que permiten la estimación de los potenciales redox del estado excitado y existe un método para la medición directa de estos potenciales. Para estimar los potenciales redox del estado excitado, un método consiste en comparar las tasas de transferencia de electrones desde el estado excitado a una serie de reactivos del estado fundamental cuyos potenciales redox se conocen. Un método más común para estimar estos potenciales es utilizar una ecuación desarrollada por Rehm y Weller que describe los potenciales del estado excitado como una corrección de los potenciales del estado fundamental:
En estas fórmulas, E* 1/2 representa el potencial de reducción u oxidación del estado excitado, E 1/2 representa el potencial de reducción u oxidación del estado fundamental, E 0,0 representa la diferencia de energía entre los estados vibracionales cero de los estados fundamental y excitado y w r representa la función de trabajo , una interacción electrostática que surge debido a la separación de cargas que ocurre durante la transferencia de electrones entre dos especies químicas. La energía de excitación cero-cero, E 0,0 , se aproxima generalmente por la transición correspondiente en el espectro de fluorescencia. Este método permite el cálculo de potenciales redox aproximados del estado excitado a partir de potenciales redox del estado fundamental y datos espectroscópicos más fáciles de medir.
La medición directa de los potenciales redox del estado excitado es posible mediante la aplicación de un método conocido como voltamperometría modulada por fase . Este método funciona haciendo brillar luz sobre una celda electroquímica para generar las especies del estado excitado deseadas, pero modulando la intensidad de la luz de forma sinusoidal , de modo que la concentración de las especies del estado excitado no sea constante. De hecho, la concentración de especies del estado excitado en la celda debería cambiar exactamente en fase con la intensidad de la luz incidente en la celda electroquímica. Si el potencial aplicado a la celda es lo suficientemente fuerte como para que se produzca la transferencia de electrones, el cambio en la concentración del estado excitado competente para redox se puede medir como una corriente alterna (CA). Además, el cambio de fase de la corriente CA en relación con la intensidad de la luz incidente corresponde a la vida media de una especie del estado excitado antes de que se dedique a la transferencia de electrones.
Los gráficos de potenciales redox para los catalizadores fotoredox más comunes están disponibles para un acceso rápido. [3]
Las naturalezas reductoras y oxidantes relativas de estos fotocatalizadores se pueden entender considerando la electronegatividad de los ligandos y el centro metálico del complejo catalizador. Los metales y ligandos más electronegativos pueden estabilizar mejor los electrones que sus contrapartes menos electronegativas. Por lo tanto, los complejos con ligandos más electronegativos son más oxidantes que los complejos de ligandos menos electronegativos. Por ejemplo, los ligandos 2,2'-bipiridina y 2,2'-fenilpiridina son estructuras isoelectrónicas, que contienen el mismo número y disposición de electrones. La fenilpiridina reemplaza uno de los átomos de nitrógeno en la bipiridina con un átomo de carbono. El carbono es menos electronegativo que el nitrógeno, por lo que retiene los electrones con menos fuerza. Dado que el resto de la molécula de ligando es idéntico y la fenilpiridina retiene los electrones con menos fuerza que la bipiridina, es más fuertemente donante de electrones y menos electronegativa como ligando. Por lo tanto, los complejos con ligandos de fenilpiridina son más fuertemente reductores y menos fuertemente oxidantes que los complejos equivalentes con ligandos de bipiridina.
De manera similar, un ligando de fenilpiridina fluorada es más electronegativo que la fenilpiridina, por lo que los complejos con ligandos que contienen flúor son más fuertemente oxidantes y menos fuertemente reductores que los complejos de fenilpiridina no sustituida equivalentes. La influencia electrónica del centro metálico en el complejo es más compleja que el efecto del ligando. Según la escala de electronegatividad de Pauling, tanto el rutenio como el iridio tienen una electronegatividad de 2,2. Si este fuera el único factor relevante para los potenciales redox, entonces los complejos de rutenio e iridio con los mismos ligandos deberían ser catalizadores fotoredox igualmente poderosos. Sin embargo, considerando la ecuación de Rehm-Weller, las propiedades espectroscópicas del metal juegan un papel en la determinación de las propiedades redox del estado excitado. [4] En particular, el parámetro E 0,0 está relacionado con la longitud de onda de emisión del complejo y, por lo tanto, con el tamaño del desplazamiento de Stokes, la diferencia de energía entre la absorción y emisión máximas de una molécula. Por lo general, los complejos de rutenio tienen grandes desplazamientos de Stokes y, por lo tanto, longitudes de onda de emisión de energía bajas y energías de excitación cero-cero pequeñas en comparación con los complejos de iridio. En efecto, mientras que los complejos de rutenio en estado fundamental pueden ser potentes reductores, el complejo en estado excitado es un reductor u oxidante mucho menos potente que su complejo de iridio equivalente. Esto hace que el iridio sea el preferido para el desarrollo de transformaciones orgánicas generales porque los potenciales redox más fuertes del catalizador excitado permiten el uso de reductores y oxidantes estequiométricos más débiles o el uso de sustratos menos reactivos. [4]
Identidad del contraión
A menudo, estos fotocatalizadores se equilibran con un contraión, como es el caso del complejo tris-(2,2'-bipiridil)rutenio , que va acompañado de dos aniones para equilibrar la carga general del par de iones a cero. Sin embargo, existen catalizadores fotorredox de metales de transición que existen sin un contraión, como el tris(2-fenilpiridina)iridio (a menudo abreviado Ir(ppy) 3 ). La importancia de estos contraiones depende de la asociación iónica entre el catalizador fotorredox y su(s) contraión(es), y depende del disolvente utilizado para la reacción. Aunque las propiedades fotofísicas, como el potencial redox, la energía de excitación y la electronegatividad del ligando, a menudo se han considerado parámetros clave para el uso y la reactividad de estos complejos, se ha demostrado que la identidad del contraión desempeña un papel importante en disolventes de baja polaridad . [5] [6] En particular, se ha demostrado que tener un contraión fuertemente asociado aumenta la tasa de transferencia de electrones cuando se reduce un sustrato, pero reduce significativamente la tasa de transferencia de electrones cuando se oxida un sustrato. Se cree que esto ocurre porque el contraión esencialmente "bloquea" la transferencia de electrones al complejo fotorredox al proteger la región con carga más positiva del complejo; mientras que tener la asociación estrecha del contraión empuja la densidad electrónica más lejos del centro metálico del catalizador fotorredox, lo que hace que sea más fácil transferirla desde el catalizador (por supuesto, esto solo se aplica al caso en el que el catalizador fotorredox es un catión y el contraión es un anión ). La identidad del contraión es, por lo tanto, un parámetro adicional a considerar al desarrollar nuevas reacciones fotorredox.
Las primeras aplicaciones de la catálisis fotorredox a la deshalogenación reductiva estaban limitadas por el estrecho alcance del sustrato o el acoplamiento reductivo competitivo. [7]
Los enlaces carbono-yodo no activados se pueden reducir utilizando el fotocatalizador fuertemente reductor tris-(2,2'- fenilpiridina )iridio (Ir(ppy) 3 ). [8] El mayor potencial de reducción de Ir(ppy) 3 en comparación con [Ru(bipy) 3 ] 2+ permite la reducción directa del enlace carbono-yodo sin interactuar con un reductor estequiométrico. Por lo tanto, el complejo de iridio transfiere un electrón al sustrato, lo que provoca la fragmentación del sustrato y oxida el catalizador al estado de oxidación Ir(IV). El fotocatalizador oxidado se devuelve a su estado de oxidación original mediante la oxidación de un aditivo de reacción.

Al igual que las reacciones de deshalogenación radical mediada por estaño, la deshalogenación reductiva fotocatalítica se puede utilizar para iniciar ciclizaciones en cascada [9].

Los iones iminio son potentes electrófilos útiles para generar enlaces CC en moléculas complejas. Sin embargo, la condensación de aminas con compuestos carbonílicos para formar iones iminio suele ser desfavorable y, a veces, requiere duras condiciones de deshidratación. Por lo tanto, los métodos alternativos para la generación de iones iminio, en particular mediante la oxidación a partir de la amina correspondiente, son una valiosa herramienta de síntesis. Los iones iminio se pueden generar a partir de aminas activadas utilizando Ir(dtbbpy)(ppy) 2PF6 como catalizador fotorredox. [10] Se propone que esta transformación se produce por oxidación de la amina al catión radical aminio por el fotocatalizador excitado. A esto le sigue la transferencia de un átomo de hidrógeno a un oxidante superestequimétrico, como el radical triclorometilo (CCl3 para formar el ion iminio). A continuación, el ion iminio se extingue mediante la reacción con un nucleófilo. Se han investigado transformaciones relacionadas de aminas con una amplia variedad de otros nucleófilos , como cianuro ( reacción de Strecker ), éteres de sililo enol ( reacción de Mannich ), fosfatos de dialquilo, silanos de alilo ( reacción de aza-Sakurai ), indoles ( reacción de Friedel-Crafts ) y acetiluros de cobre. [11] [12] [13] [14] [15]

También se ha logrado una generación fotoredox similar de iones iminio utilizando catalizadores fotoredox puramente orgánicos, como rosa de Bengala y eosina Y. [ 16] [17] [18]
Una variante asimétrica de esta reacción utiliza equivalentes de nucleófilos acilo generados por catálisis de carbeno N-heterocíclico . [19] Este método de reacción evita el problema de la mala enantioinducción de los catalizadores fotoredox quirales al mover la fuente de enantioselectividad al carbeno N-heterocíclico.
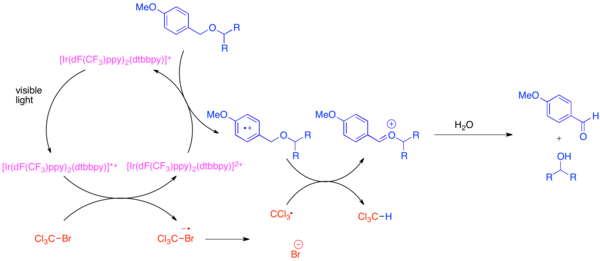
El desarrollo de grupos protectores ortogonales es un problema en la síntesis orgánica porque estos grupos protectores permiten distinguir cada instancia de un grupo funcional común, como el grupo hidroxilo , durante la síntesis de una molécula compleja. Un grupo protector muy común para el grupo funcional hidroxilo es el para -metoxibenciléter (PMB). Este grupo protector es químicamente similar al éter bencílico menos rico en electrones. Normalmente, la escisión selectiva de un éter PMB en presencia de un éter bencílico utiliza oxidantes estequiométricos fuertes como la 2,3-dicloro-5,6-diciano-1,4-benzoquinona (DDQ) o el nitrato de amonio cérico (CAN). Los éteres PMB son mucho más susceptibles a la oxidación que los éteres bencílicos, ya que son más ricos en electrones. La desprotección selectiva de los éteres de PMB se puede lograr mediante el uso de hexafluorofosfato de bis-(2-(2',4'-difluorofenil)-5-trifluorometilpiridina)-(4,4'-diterbutilbipiridina)iridio(III) (Ir[dF(CF 3 )ppy] 2 (dtbbpy)PF 6 ) y un oxidante estequiométrico suave como bromotriclorometano, BrCCl 3 . [20] El catalizador de iridio fotoexcitado es lo suficientemente reductor como para fragmentar el bromotriclorometano para formar un radical triclorometilo, un anión bromuro y el complejo Ir(IV). Los ligandos fluorados pobres en electrones hacen que el complejo de iridio se oxide lo suficiente como para aceptar un electrón de un areno rico en electrones como un éter de PMB. Una vez oxidado el areno, participará fácilmente en la transferencia de átomos de hidrógeno con el radical triclorometilo para formar cloroformo y un ion oxocarbenio , que se hidroliza fácilmente para revelar el hidróxido libre. Se demostró que esta reacción era ortogonal a muchos grupos protectores comunes cuando se agregó una base para neutralizar el HBr producido.
Las cicloadiciones y otras reacciones pericíclicas son transformaciones poderosas en la síntesis orgánica debido a su potencial para generar rápidamente arquitecturas moleculares complejas y, en particular, debido a su capacidad para establecer múltiples estereocentros adyacentes de una manera altamente controlada. Sin embargo, solo se permiten ciertas cicloadiciones en condiciones térmicas de acuerdo con las reglas de simetría orbital de Woodward-Hoffmann u otros modelos equivalentes, como la teoría de orbitales moleculares de frontera (FMO) o el modelo de Dewar-Zimmermann. Las cicloadiciones que no están permitidas térmicamente, como la cicloadición [2+2], se pueden habilitar mediante la activación fotoquímica de la reacción. En condiciones no catalizadas, esta activación requiere el uso de luz ultravioleta de alta energía capaz de alterar las poblaciones orbitales de los compuestos reactivos. Alternativamente, se ha informado que los catalizadores metálicos como el cobalto y el cobre catalizan cicloadiciones [2+2] prohibidas térmicamente a través de la transferencia de un solo electrón.
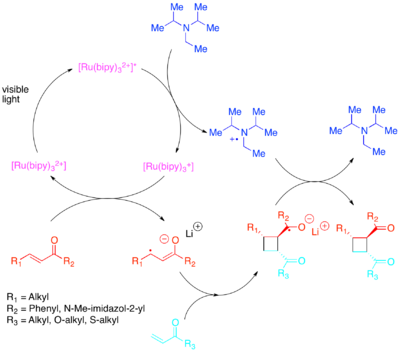
El cambio requerido en las poblaciones orbitales se puede lograr mediante transferencia de electrones con un fotocatalizador sensible a la luz visible de menor energía. [21] [22] [23] [24] [25] Yoon demostró las eficientes cicloadiciones intra e intermoleculares [2+2] de olefinas activadas : particularmente enonas y estirenos. Se descubrió que las enonas, u olefinas pobres en electrones, reaccionan a través de una vía radical-anión, utilizando diisopropiletilamina como fuente transitoria de electrones. Para esta transferencia de electrones, se descubrió que [Ru(bipy) 3 ] 2+ era un fotocatalizador eficiente. La naturaleza aniónica de la ciclización resultó ser crucial: realizar la reacción en ácido en lugar de con un contraión de litio favoreció una vía de no cicloadición. [26] Zhao et al. también descubrieron que hay una vía de ciclización aún diferente disponible para las chalconas con un contraión de samario . [27] Por el contrario, se descubrió que los estirenos ricos en electrones reaccionaban a través de un mecanismo de radical-catión, utilizando metilviológeno u oxígeno molecular como sumidero transitorio de electrones. Si bien [Ru(bipy) 3 ] 2+ demostró ser un catalizador competente para ciclizaciones intramoleculares utilizando metilviológeno , no pudo usarse con oxígeno molecular como sumidero de electrones o para ciclizaciones intermoleculares. Para ciclizaciones intermoleculares, Yoon et al. descubrieron que el fotocatalizador oxidante más fuerte [Ru(bpm) 3 ] 2+ y el oxígeno molecular proporcionaban un sistema catalítico más adecuado para acceder al catión radical necesario para que se produzca la cicloadición. [Ru(bpz) 3 ] 2+ , un fotocatalizador aún más fuertemente oxidante, resultó ser problemático porque si bien podía catalizar la cicloadición [2+2] deseada, también era lo suficientemente fuerte como para oxidar el cicloaducto y catalizar la reacción retro-[2+2]. Esta comparación de fotocatalizadores destaca la importancia de ajustar las propiedades redox de un fotocatalizador al sistema de reacción, así como demostrar el valor de los compuestos de polipiridilo como ligandos, debido a la facilidad con la que se pueden modificar para ajustar las propiedades redox de sus complejos.

Las cicloadiciones [2+2] catalizadas por fotorredox también se pueden efectuar con un catalizador fotorredox orgánico de trifenilpirilio. [28]

Además de la cicloadición [2+2], prohibida térmicamente, se puede aplicar la catálisis fotorredox a la ciclización [4+2] ( reacción de Diels–Alder ). Las bisenonas, similares a los sustratos utilizados para la ciclización fotorredox [2+2], pero con un enlace más largo que une los dos grupos funcionales enona, experimentan reacciones hetero-Diels–Alder de radical-anión intramolecular más rápidamente que la cicloadición [2+2]. [29]

De manera similar, los estirenos ricos en electrones participan en ciclizaciones de Diels-Alder intramoleculares o intermoleculares a través de un mecanismo de catión radical. [30] [31] [Ru(bipy) 3 ] 2+ fue un catalizador competente para ciclizaciones de Diels-Alder intermoleculares, pero no intramoleculares. Esta reacción de Diels-Alder catalizada por fotorredox permite la cicloadición entre dos sustratos electrónicamente desapareados. La demanda electrónica normal para la reacción de Diels-Alder requiere que un dieno rico en electrones reaccione con una olefina pobre en electrones (o "dienófilo"), mientras que la reacción de Diels-Alder de demanda electrónica inversa tiene lugar entre el caso opuesto de un dieno pobre en electrones y un dienófilo muy rico en electrones. El caso fotoredox, dado que se produce por un mecanismo diferente a la reacción térmica de Diels-Alder, permite la cicloadición entre un dieno rico en electrones y un dienófilo rico en electrones, permitiendo el acceso a nuevas clases de aductos de Diels-Alder.

El valor sintético de la reacción de Diels-Alder del estireno catalizada por fotorredox de Yoon se demostró a través de la síntesis total del producto natural Heitziamide A. [30] Esta síntesis demuestra que la reacción térmica de Diels-Alder favorece al regioisómero no deseado, pero la reacción catalizada por fotorredox proporciona el regioisómero deseado con un rendimiento mejorado.

La organocatálisis es un subcampo de la catálisis que explora el potencial de las moléculas pequeñas orgánicas como catalizadores, particularmente para la creación enantioselectiva de moléculas quirales. Una estrategia en este subcampo es el uso de aminas secundarias quirales para activar compuestos carbonílicos. En este caso, la condensación de la amina con el compuesto carbonílico genera una enamina nucleófila . La amina quiral está diseñada de modo que una cara de la enamina esté protegida estéricamente y de modo que solo la cara no protegida esté libre para reaccionar. A pesar del poder de este enfoque para catalizar la funcionalización enantioselectiva de compuestos carbonílicos, ciertas transformaciones valiosas, como la α-alquilación enantioselectiva catalítica de aldehídos , seguían siendo esquivas. La combinación de organocatálisis y métodos fotorredox proporciona una solución catalítica a este problema. [32] En este enfoque para la α-alquilación de aldehídos, [Ru(bipy) 3 ] 2+ fragmenta reductivamente un haluro de alquilo activado, como bromomalonato o bromuro de fenacilo , que luego puede agregarse a la enamina generada catalíticamente de una manera enantioselectiva. Luego, el fotocatalizador oxidado extingue oxidativamente el radical α-amino resultante para formar un ion iminio, que se hidroliza para dar el compuesto carbonílico funcionalizado. Se demostró que esta transformación fotorredox es mecánicamente distinta de otro proceso radical organocatalítico denominado catálisis de orbital molecular ocupado individualmente (SOMO). La catálisis SOMO emplea nitrato de amonio cérico superestequiométrico (CAN) para oxidar la enamina generada catalíticamente al catión radical correspondiente, que luego puede agregarse a un socio de acoplamiento adecuado como el alil silano. Este tipo de mecanismo se excluye para la reacción de alquilación fotocatalítica porque, mientras que se observó que el catión radical enamina se ciclaba sobre olefinas colgantes y abría relojes radicales de ciclopropano en la catálisis SOMO, estas estructuras no eran reactivas en la reacción fotoredox.
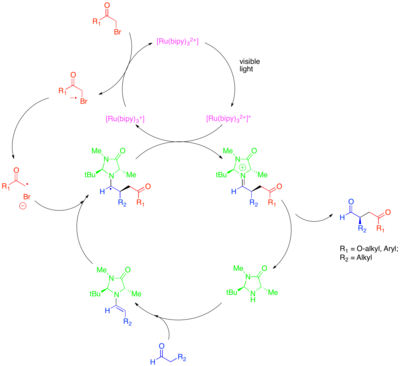
Esta transformación incluye alquilaciones con otras clases de haluros de alquilo activados de interés sintético. En particular, el uso del fotocatalizador Ir(dtbbpy)(ppy) 2+ permite la α-trifluorometilación enantioselectiva de aldehídos, mientras que el uso de Ir(ppy) 3 permitió el acoplamiento enantioselectivo de aldehídos con bromuros bencílicos pobres en electrones. [33] [34] Zeitler et al. también investigaron la fusión productiva de métodos fotorredox y organocatalíticos para lograr la alquilación enantioselectiva de aldehídos. [35] Se utilizó el mismo organocatalizador quiral de imidazolidinona para formar enamina e introducir quiralidad. Sin embargo, se utilizó el catalizador fotorredox orgánico Eosin Y en lugar de un complejo de rutenio o iridio.
La β-arilación directa de aldehídos y cetonas saturados se puede efectuar mediante la combinación de métodos fotorredox y organocatalíticos. [36] El método anterior para lograr la β-funcionalización directa de un carbonilo saturado consiste en un proceso de una sola etapa que consta de dos pasos, ambos catalizados por un organocatalizador de amina secundaria: reducción estequiométrica de un aldehído con IBX seguida de la adición de un nucleófilo de alquilo activado a la posición beta del enal resultante . [37] Esta transformación, que al igual que otros procesos fotorredox tiene lugar mediante un mecanismo radical, se limita a la adición de arenos altamente electrofílicos a la posición beta. Las severas limitaciones en el alcance del componente areno en esta reacción se deben principalmente a la necesidad de un anión radical areno que sea lo suficientemente estable como para no reaccionar directamente con la enamina o el catión radical enamina. En el mecanismo propuesto, el catalizador fotorredox activado se extingue oxidativamente mediante un areno deficiente en electrones, como el 1,4-dicianobenceno . A continuación, el fotocatalizador oxida una especie de enamina, generada transitoriamente por la condensación de un aldehído con un cocatalizador de amina secundaria, como la isopropilbencilamina óptima. El catión radical enamina resultante suele reaccionar como un sistema de 3 electrones π, pero debido a la estabilidad de los socios de acoplamiento radical, la desprotonación de la posición β-metileno da lugar a un sistema de 5 electrones π con un fuerte carácter radical en el carbono β recién accedido. Aunque esta reacción se basa en el uso de un organocatalizador de amina secundaria para generar la especie de enamina que se oxida en el mecanismo propuesto, no existe ninguna variante enantioselectiva de esta reacción.

El desarrollo de esta β-arilación directa de aldehídos condujo a reacciones relacionadas para la β-funcionalización de cetonas cíclicas. En particular, la β-arilación de cetonas cíclicas se ha logrado en condiciones de reacción similares, pero utilizando azepano como cocatalizador de amina secundaria. Una reacción fotocatalítica "homo-aldólica" funciona para cetonas cíclicas, permitiendo el acoplamiento de la posición beta de la cetona al carbono ipso de las arilcetonas, como la benzofenona y la acetofenona . [38] Además del cocatalizador de azepano, esta reacción requiere el uso del catalizador fotorredox más fuertemente reductor Ir(ppy) 3 y la adición de hexafluoroarseniuro de litio (LiAsF 6 ) para promover la reducción de un solo electrón de la arilcetona.
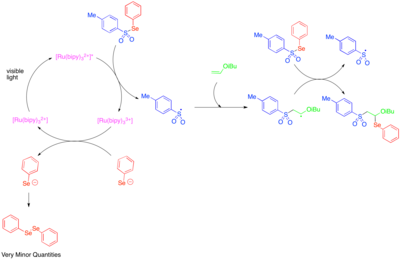
El uso de catálisis fotorredox para generar radicales reactivos centrados en heteroátomos se exploró por primera vez en la década de 1990. [39] Se descubrió que [Ru(bipy) 3 ] 2+ catalizaba la fragmentación de tosilfenilseleniuro al anión fenilselenolato y al radical tosilo y que un mecanismo de propagación de cadena radical permitía la adición del radical tosilo y el radical fenilseleno- a través del doble enlace de alquil vinil éteres ricos en electrones. Dado que el anión fenilselenolato se oxida fácilmente a difenildiseleno, las bajas cantidades de difenildiseleno observadas se tomaron como una indicación de que la fragmentación catalizada por fotorredox de tosilfenilseleno solo era importante como paso de iniciación y que la mayor parte de la reactividad se debía a un proceso de cadena radical.
Las adiciones heteroaromáticas a olefinas incluyen reacciones de oxi y aminotrifluorometilación multicomponente. [40] [41] Estas reacciones utilizan el reactivo de Umemoto, una sal de sulfonio que sirve como fuente electrofílica del grupo trifluorometilo y que tiene precedentes en reaccionar a través de una vía de transferencia de un solo electrón. Por lo tanto, la reducción de un solo electrón del reactivo de Umemoto libera el radical trifluorometilo, que se agrega a la olefina reactiva. Posteriormente, la oxidación de un solo electrón del radical alquilo generado por esta adición produce un catión que puede ser atrapado por agua, un alcohol o un nitrilo. Para lograr altos niveles de regioselectividad, esta reactividad se ha explorado principalmente para estirenos, que están sesgados hacia la formación del intermediario radical bencílico.

La hidrotrifluorometilación de estirenos y alquenos alifáticos se puede efectuar con un catalizador fotorredox orgánico de mesitilacridinio y el reactivo de Langlois como fuente del radical CF3 . [42] En esta reacción, se encontró que el trifluoroetanol y cantidades subestequiométricas de un tiol aromático, como el tiosalicilato de metilo, empleados en conjunto sirvieron como la mejor fuente de radical hidrógeno para completar el ciclo catalítico.
Las hidroeterificaciones e hidroaminaciones intramoleculares se llevan a cabo con selectividad anti-Markovnikov. [43] [44] Un mecanismo invoca la oxidación de un solo electrón de la olefina, atrapando el catión radical por un grupo funcional hidroxilo o amina colgante y apagando el radical alquilo resultante por transferencia de átomos de H desde una especie donante altamente lábil. Las extensiones de esta reactividad a sistemas intermoleculares han dado como resultado i) una nueva ruta sintética para tetrahidrofuranos complejos mediante una "cicloadición de cruce de radicales polares" (reacción PRCC) de un alcohol alílico con una olefina, y ii) la adición anti-Markovnikov de ácidos carboxílicos a olefinas. [45] [46]
La sulfoximación de arenos ricos en electrones se permite mediante catálisis fotoredox. [47]