
La voltamperometría es una categoría de métodos electroanalíticos que se utilizan en la química analítica y en diversos procesos industriales. En la voltamperometría, la información sobre un analito se obtiene midiendo la corriente a medida que varía el potencial . [1] [2] Los datos analíticos para un experimento voltamperométrico se presentan en forma de voltamograma , que representa gráficamente la corriente producida por el analito frente al potencial del electrodo de trabajo . [3]
La voltamperometría es el estudio de la corriente en función del potencial aplicado. Los métodos voltamperométricos involucran celdas electroquímicas e investigan las reacciones que ocurren en las interfaces electrodo/electrolito. [4] La reactividad de los analitos en estas semiceldas se utiliza para determinar su concentración. Se considera un método electroquímico dinámico ya que el potencial aplicado varía con el tiempo y se miden los cambios correspondientes en la corriente. [4] La mayoría de los experimentos controlan el potencial ( voltios ) de un electrodo en contacto con el analito mientras se mide la corriente resultante ( amperios ).
Las celdas electroquímicas se utilizan en experimentos voltamperométricos para impulsar la reacción redox del analito. Al igual que otras celdas electroquímicas, se requieren dos semiceldas, una para facilitar la reducción y la otra la oxidación. La celda consta de una solución de analito, un electrolito iónico y dos o tres electrodos, y las reacciones de oxidación y reducción ocurren en las interfaces electrodo/electrolito. [5] A medida que se oxida una especie, los electrones producidos pasan a través de un circuito eléctrico externo y generan una corriente, que actúa como una fuente de electrones para la reducción. Las corrientes generadas son corrientes faradaicas, que siguen la ley de Faraday. Como la ley de Faraday establece que la cantidad de moles de una sustancia, m, producida o consumida durante un proceso de electrodo es proporcional a la carga eléctrica que pasa a través del electrodo, las corrientes faradaicas permiten determinar las concentraciones de analito. [6] Si el analito se reduce u oxida depende del analito, pero su reacción siempre ocurre en el electrodo de trabajo/indicador. Por lo tanto, el potencial del electrodo de trabajo varía en función de la concentración del analito. Un segundo electrodo auxiliar completa el circuito eléctrico. Un tercer electrodo de referencia proporciona una lectura de potencial de referencia constante con la que se pueden comparar los potenciales de los otros dos electrodos.

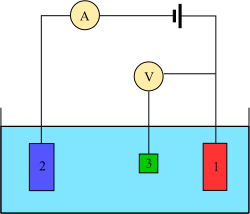
Los experimentos de voltamperometría investigan la reactividad de la semicelda de un analito . La voltamperometría es el estudio de la corriente en función del potencial aplicado. Estas curvas I = f(E) se denominan voltamogramas. El potencial se varía arbitrariamente, ya sea paso a paso o de forma continua, y el valor de corriente resultante se mide como variable dependiente. Lo opuesto, es decir, la amperometría , también es posible pero no común. La forma de las curvas depende de la velocidad de variación del potencial (naturaleza de la fuerza impulsora) y de si la solución está agitada o en reposo (transferencia de masa). La mayoría de los experimentos controlan el potencial ( voltios ) de un electrodo en contacto con el analito mientras se mide la corriente resultante ( amperios ). [7]
Para llevar a cabo un experimento de este tipo, se requieren al menos dos electrodos. El electrodo de trabajo , que hace contacto con el analito, debe aplicar el potencial deseado de forma controlada y facilitar la transferencia de carga hacia y desde el analito. Un segundo electrodo actúa como la otra mitad de la celda. Este segundo electrodo debe tener un potencial conocido para medir el potencial del electrodo de trabajo; además, debe equilibrar la carga agregada o eliminada por el electrodo de trabajo. Si bien esta es una configuración viable, tiene una serie de deficiencias. La más importante es que es extremadamente difícil para un electrodo mantener un potencial constante mientras pasa corriente para contrarrestar los eventos redox en el electrodo de trabajo. [7]
Para resolver este problema, las funciones de suministrar electrones y proporcionar un potencial de referencia se dividen entre dos electrodos separados. El electrodo de referencia es una media celda con un potencial de reducción conocido. Su única función es actuar como referencia para medir y controlar el potencial del electrodo de trabajo y no pasa ninguna corriente. El electrodo auxiliar pasa la corriente necesaria para equilibrar la corriente observada en el electrodo de trabajo. Para lograr esta corriente, el auxiliar a menudo oscilará a potenciales extremos en los bordes de la ventana de disolvente , donde oxida o reduce el disolvente o el electrolito de soporte. Estos electrodos, el de trabajo , el de referencia y el auxiliar, forman el sistema moderno de tres electrodos. [7]
Existen muchos sistemas que tienen más electrodos, pero sus principios de diseño son similares a los del sistema de tres electrodos. Por ejemplo, el electrodo de disco-anillo giratorio tiene dos electrodos de trabajo distintos y separados, un disco y un anillo, que se pueden utilizar para escanear o mantener potenciales de forma independiente uno del otro. Ambos electrodos se equilibran mediante una única combinación de referencia y auxiliar para un diseño general de cuatro electrodos. En experimentos más complicados se pueden añadir electrodos de trabajo, de referencia o auxiliares según sea necesario. [7]
En la práctica, puede ser importante tener un electrodo de trabajo con dimensiones y características de superficie conocidas. Como resultado, es común limpiar y pulir los electrodos de trabajo regularmente. El electrodo auxiliar puede ser casi cualquier cosa siempre que no reaccione con la mayor parte de la solución de analito y conduzca bien. Un método de voltamperometría común, la polarografía, utiliza mercurio como electrodo de trabajo, por ejemplo, DME y HMDE , y como electrodo auxiliar. La referencia es el más complejo de los tres electrodos; se utilizan una variedad de estándares. Para el trabajo no acuoso, la IUPAC recomienda el uso de la pareja ferroceno / ferrocenio como estándar interno. [8] En la mayoría de los experimentos de voltamperometría, se utiliza un electrolito a granel (también conocido como electrolito de soporte ) para minimizar la resistencia de la solución. Es posible ejecutar un experimento sin un electrolito a granel, pero la resistencia agregada reduce en gran medida la precisión de los resultados. Con líquidos iónicos a temperatura ambiente , el solvente puede actuar como electrolito. [7]


Un voltamograma es un gráfico que mide la corriente de una celda electroquímica en función del potencial aplicado. [9] Este gráfico se utiliza para determinar la concentración y el potencial estándar del analito. Para determinar la concentración, se leen del gráfico valores como la corriente límite o pico y se aplican a varios modelos matemáticos. [10] Después de determinar la concentración, se puede identificar el potencial estándar aplicado utilizando la ecuación de Nernst. [10]
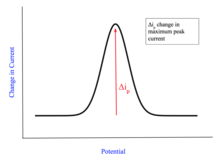
Existen tres formas principales para los voltamogramas. La primera forma depende de la capa de difusión. [1] Si el analito se agita continuamente, la capa de difusión tendrá un ancho constante y producirá un voltamograma que alcanza una corriente constante. El gráfico toma esta forma a medida que la corriente aumenta desde el residuo de fondo hasta alcanzar la corriente límite (i l ). Si la mezcla no se agita, el ancho de la capa de difusión aumenta eventualmente. Esto se puede observar por la corriente pico máxima (i p ), y se identifica por el punto más alto en el gráfico. La tercera forma común para un voltamograma mide la muestra para el cambio en la corriente en lugar de la corriente aplicada. Todavía se observa una corriente máxima, pero representa el cambio máximo en la corriente ( i p ). [10]
Para determinar las concentraciones de analito, se requieren modelos matemáticos que vinculen el potencial aplicado y la corriente medida a lo largo del tiempo. La ecuación de Nernst relaciona el potencial de la celda electroquímica con la relación de concentración de las especies reducidas y oxidadas en una relación logarítmica. [6] La ecuación de Nernst es la siguiente:
Dónde:
Esta ecuación describe cómo los cambios en el potencial aplicado alterarán la relación de concentración. Sin embargo, la ecuación de Nernst es limitada, ya que se modela sin un componente de tiempo y los experimentos voltamétricos varían el potencial aplicado en función del tiempo. Otros modelos matemáticos, principalmente la ecuación de Butler-Volmer, la ecuación de Tafel y la ley de Fick abordan la dependencia del tiempo.
La ecuación de Butler-Volmer relaciona la concentración, el potencial y la corriente en función del tiempo. [5] Describe la relación no lineal entre la diferencia de voltaje entre el electrodo y el electrolito y la corriente eléctrica. Ayuda a hacer predicciones sobre cómo las reacciones redox directas e inversas afectan el potencial e influyen en la reactividad de la celda. [11] Esta función incluye una constante de velocidad que explica la cinética de la reacción. Una versión compacta de la ecuación de Butler-Volmer es la siguiente:
Dónde:
En caso de sobrepotenciales elevados , la ecuación de Butler-Volmer se simplifica a la ecuación de Tafel . La ecuación de Tafel relaciona las corrientes electroquímicas con el sobrepotencial de forma exponencial y se utiliza para calcular la velocidad de reacción. [11] El sobrepotencial se calcula en cada electrodo por separado y se relaciona con los datos del voltamograma para determinar las velocidades de reacción. La ecuación de Tafel para un solo electrodo es:
Dónde:
A medida que las especies redox se oxidan y reducen en los electrodos, el material se acumula en la interfaz electrodo/electrolito. [5] La acumulación de material crea un gradiente de concentración entre la interfaz y la solución en masa. Las leyes de difusión de Fick se utilizan para relacionar la difusión de especies oxidadas y reducidas con la corriente faradaica utilizada para describir los procesos redox. La ley de Fick se escribe más comúnmente en términos de moles y es la siguiente:
Dónde:
El comienzo de la voltamperometría fue facilitado por el descubrimiento de la polarografía en 1922 por el químico checo ganador del Premio Nobel Jaroslav Heyrovský . [23] Las primeras técnicas voltamperométricas tenían muchos problemas, lo que limitaba su viabilidad para el uso cotidiano en química analítica. En la polarografía, estos problemas incluían el hecho de que el mercurio se oxida a un potencial que es más positivo que +0,2 voltios, lo que dificulta el análisis de los resultados de los analitos en la región positiva del potencial. Otro problema incluía la corriente residual obtenida de la carga de la gran capacitancia de la superficie del electrodo . [24] Cuando Heyrovsky registró por primera vez la primera dependencia de la corriente que fluye a través del electrodo de mercurio que cae sobre el potencial aplicado en 1922, tomó mediciones punto por punto y trazó una curva de corriente-voltaje. Esto se consideró el primer polarograma. Para facilitar este proceso, construyó lo que ahora se conoce como un polarógrafo con M. Shikata, que le permitió registrar fotográficamente la misma curva en cuestión de horas. Reconoció la importancia del potencial y su control y también reconoció las oportunidades de medir las corrientes limitantes. También fue una parte importante de la introducción del electrodo de mercurio como una herramienta moderna. [25]
En 1942, el electroquímico inglés Archie Hickling ( Universidad de Leicester ) construyó el primer potenciostato de tres electrodos , lo que supuso un avance para el campo de la electroquímica. [26] Utilizó este potenciostato para controlar el voltaje de un electrodo. Mientras tanto, a finales de la década de 1940, el biofísico estadounidense Kenneth Stewart Cole inventó un circuito electrónico al que llamó pinza de voltaje. La pinza de voltaje se utilizó para analizar la conducción iónica en los nervios . [27]
En los años 1960 y 1970 se produjeron muchos avances en la teoría, la instrumentación y la introducción de sistemas controlados y asistidos por ordenador. Los métodos polarográficos y voltamétricos modernos con electrodos de mercurio surgieron en tres etapas.
La primera sección incluye el desarrollo de los electrodos de mercurio. Se produjeron los siguientes electrodos: electrodo de mercurio de goteo , electrodo de mercurio de vapor, electrodo de mercurio de goteo colgante, electrodo de mercurio de goteo estático, electrodo de película de mercurio, electrodos de amalgama de mercurio, microelectrodos de mercurio, electrodos de mercurio modificados químicamente, electrodos de mercurio de crecimiento controlado y electrodos de mercurio de goteo contráctiles.
También se produjo un avance en las técnicas de medición utilizadas. Estas técnicas de medición incluyen: polarografía clásica de CC, oscilopolarografía, conmutador de Kaloussek, polarografía de CA, polarografía de Tast, polarografía de pulso normal, polarografía de pulso diferencial, voltamperometría de onda cuadrada, voltamperometría cíclica , voltamperometría de desorción anódica , técnicas de convolución y métodos de eliminación.
Por último, también se produjo un avance en las técnicas de preconcentración que produjeron un aumento en la sensibilidad de los electrodos de mercurio. Esto se produjo mediante el desarrollo de la voltamperometría de redisolución anódica , la voltamperometría de redisolución catódica y la voltamperometría de redisolución adsortiva . [25]
Estos avances mejoraron la sensibilidad y crearon nuevos métodos analíticos, lo que impulsó a la industria a responder con la producción de potenciostatos , electrodos y celdas más económicos que pudieran usarse eficazmente en el trabajo analítico de rutina.
Se producen comercialmente varios sistemas voltamétricos para la determinación de especies de interés para la industria y la investigación. Estos dispositivos a veces se denominan electrodos , pero en realidad son celdas voltamétricas completas, a las que se denomina mejor sensores . Estos sensores se pueden emplear para el análisis de analitos orgánicos e inorgánicos en diversas matrices. [28]
La determinación del oxígeno disuelto en una variedad de entornos acuosos, como agua de mar, sangre, aguas residuales, efluentes de plantas químicas y suelos, es de enorme importancia para la industria, la investigación biomédica y ambiental y la medicina clínica. Uno de los métodos más comunes y convenientes para realizar dichas mediciones es con el sensor de oxígeno Clark , que fue patentado por LC Clark, Jr. en 1956.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )