
La ficocianina es un complejo de pigmento -proteína de la familia de las ficobiliproteínas que captan luz , junto con la aloficocianina y la ficoeritrina . [1] Es un pigmento accesorio de la clorofila . Todas las ficobiliproteínas son solubles en agua, por lo que no pueden existir dentro de la membrana como pueden hacerlo los carotenoides . En cambio, las ficobiliproteínas se agregan para formar grupos que se adhieren a la membrana llamados ficobilisomas . La ficocianina es de un color azul claro característico, que absorbe luz naranja y roja, particularmente 620 nm (dependiendo de qué tipo específico sea), y emite fluorescencia a aproximadamente 650 nm (también dependiendo de qué tipo sea). La aloficocianina absorbe y emite en longitudes de onda más largas que la ficocianina C o la ficocianina R. Las ficocianinas se encuentran en las cianobacterias (también llamadas algas verdeazuladas ). [2] Las ficobiliproteínas tienen propiedades fluorescentes que se utilizan en los kits de inmunoensayo . La ficocianina proviene del griego phyco que significa “ alga ” y la cianina proviene de la palabra inglesa “ cyan ”, que convencionalmente significa un tono de azul verdoso (cercano a “aqua”) y se deriva del griego “ kyanos ”, que significa un color algo diferente: “azul oscuro”. El producto ficocianina, producido por Aphanizomenon flos-aquae y Spirulina , se utiliza, por ejemplo, en la industria de alimentos y bebidas como el agente colorante natural 'Lina Blue' o 'EXBERRY Shade Blue' y se encuentra en dulces y helados. Además, la detección de fluorescencia de pigmentos de ficocianina en muestras de agua es un método útil para monitorear la biomasa de cianobacterias. [3]
Las ficobiliproteínas están formadas por dos subunidades (alfa y beta) que tienen una estructura proteica a la que se unen covalentemente 1 o 2 cromóforos tetrapirrol lineales.
La c-ficocianina se encuentra a menudo en las cianobacterias que prosperan alrededor de fuentes termales, ya que puede ser estable hasta alrededor de 70 °C, con comportamientos espectroscópicos (absorción de luz) idénticos a 20 y 70 °C. Los termófilos contienen secuencias de aminoácidos ligeramente diferentes, lo que la hace estable en estas condiciones más elevadas. El peso molecular es de alrededor de 30.000 Da. Se ha demostrado que la estabilidad de esta proteína in vitro a estas temperaturas es sustancialmente menor. El análisis fotoespectral de la proteína después de 1 minuto de exposición a condiciones de 65 °C en un estado purificado demostró una pérdida del 50% de la estructura terciaria.

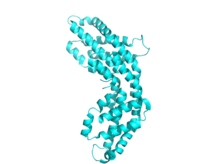
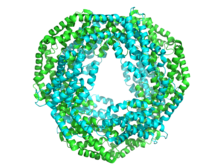
La ficocianina comparte un tema estructural común con todas las ficobiliproteínas . [4] La estructura comienza con el ensamblaje de los monómeros de ficobiliproteína, que son heterodímeros compuestos por subunidades α y β, y sus respectivos cromóforos unidos a través de un enlace tioéter .
Cada subunidad se compone típicamente de ocho hélices α . Los monómeros se agregan espontáneamente para formar trímeros en forma de anillo (αβ) 3 , que tienen simetría rotacional y un canal central. Los trímeros se agregan en pares para formar hexámeros (αβ) 6 , a veces asistidos con proteínas de enlace adicionales. Cada varilla de ficobilisoma generalmente tiene dos o más hexámeros de ficocianina. A pesar de la similitud general en la estructura y el ensamblaje de las ficobiliproteínas, existe una gran diversidad en las conformaciones de hexámeros y varillas, incluso cuando solo se consideran las ficocianinas. A mayor escala, las ficocianinas también varían en la estructura cristalina , aunque la relevancia biológica de esto es discutible.
Como ejemplo, la estructura de la C-ficocianina de Synechococcus vulcanus se ha refinado a una resolución de 1,6 Angstroms . [5] El monómero (αβ) consta de 332 aminoácidos y 3 moléculas de cofactor de ficocianobilina (PCB) unidas por tio . Tanto la subunidad α como la β tienen un PCB en el aminoácido 84, pero la subunidad β también tiene un PCB adicional en la posición 155. Este PCB adicional está orientado hacia el exterior del anillo trimérico y, por lo tanto, está implicado en la transferencia de energía entre barras en el complejo ficobilisoma. Además de los cofactores, existen muchas interacciones no covalentes predecibles con el disolvente circundante (agua) que se supone que contribuyen a la estabilidad estructural.
La R-ficocianina II (R-PC II) se encuentra en algunas especies de Synechococcus . [6] Se dice que la R-PC II es el primer PEB que contiene ficocianina que se origina en las cianobacterias. [6] Su proteína purificada está compuesta de subunidades alfa y beta en cantidades iguales. [6] La R-PC II tiene PCB en beta-84 y la ficoeritrobilina (PEB) en alfa-84 y beta-155. [6]
Al 21 de marzo de 2023, hay 310 estructuras cristalinas de ficocianina depositadas en el Banco de Datos de Proteínas . [7]
La C-ficocianina tiene un único pico de absorción a ~621 nm, [8] [9] que varía ligeramente dependiendo del organismo y de las condiciones como la temperatura, el pH y la concentración de proteínas in vitro . [10] [11] Su máximo de emisión es ~642 nm. [8] [9] Esto significa que el pigmento absorbe luz naranja y emite luz rojiza. La R-ficocianina tiene un máximo de absorción a 533 y 544 nm. [6] El máximo de emisión de fluorescencia de la R-ficocianina es 646 nm. [6]
La ficocianina es producida por muchas cianobacterias fotoautotróficas . [12] Incluso si las cianobacterias tienen grandes concentraciones de ficocianina, la productividad en el océano aún es limitada debido a las condiciones de luz. [12]
La ficocianina tiene importancia ecológica al indicar la proliferación de cianobacterias. Normalmente, se utiliza la clorofila a para indicar la cantidad de cianobacterias, sin embargo, dado que está presente en una gran cantidad de grupos de fitoplancton, no es una medida ideal. [13] Por ejemplo, un estudio en el mar Báltico utilizó la ficocianina como marcador de cianobacterias filamentosas durante las floraciones tóxicas de verano. [13] Algunos organismos filamentosos en el mar Báltico incluyen Nodularia spumigena y Aphanizomenon flosaquae .
Una cianobacteria importante llamada espirulina ( Arthrospira platensis ) es una microalga que produce C-PC. [14]
Existen muchos métodos diferentes de producción de ficocianina, incluida la producción fotoautotrófica, mixotrófica, heterotrófica y recombinante. [15] La producción fotoautotrófica de ficocianina es donde los cultivos de cianobacterias se cultivan en estanques abiertos en regiones subtropicales o tropicales. [15] La producción mixotrófica de algas es donde las algas se cultivan en cultivos que tienen una fuente de carbono orgánico como la glucosa . [15] El uso de la producción mixotrófica produce mayores tasas de crecimiento y mayor biomasa en comparación con el simple uso de un cultivo fotoautotrófico. [15] En el cultivo mixotrófico, la suma del crecimiento heterotrófico y autótrofo por separado fue igual al crecimiento mixotrófico. [16] La producción heterotrófica de ficocianina no está limitada por la luz, según su definición. [15] Galdieria sulphuraria es un rodofito unicelular que contiene una gran cantidad de C-PC y una pequeña cantidad de aloficocianina . [15] G. sulphuraria es un ejemplo de producción heterotrófica de C-PC porque su hábitat son manantiales calientes y ácidos y utiliza varias fuentes de carbono para su crecimiento. [15] La producción recombinante de C-PC es otro método heterotrófico e implica ingeniería genética. [15]
Los hongos formadores de líquenes y las cianobacterias suelen tener una relación simbiótica y, por lo tanto, los marcadores de ficocianina se pueden utilizar para mostrar la distribución ecológica de las cianobacterias asociadas a los hongos. Como se muestra en la asociación altamente específica entre las especies de Lichina y las cepas de Rivularia , la ficocianina tiene suficiente resolución filogenética para resolver la historia evolutiva del grupo a lo largo del margen costero del noroeste del Océano Atlántico . [17]
Los dos genes cpcA y cpcB, ubicados en el operón cpc y traducidos a partir del mismo transcrito de ARNm, codifican las cadenas α y β de C-PC respectivamente. [18] Elementos adicionales como proteínas de enlace y enzimas involucradas en la síntesis de ficobilina y las ficobiliproteínas a menudo son codificados por genes en grupos de genes adyacentes, y el operón cpc de Arthrospira platensis también codifica una proteína de enlace que ayuda en el ensamblaje de complejos C-PC. [19] En las algas rojas, los genes de la ficobiliproteína y la proteína de enlace se encuentran en el genoma del plástido. [20]
La ficocianobilina se sintetiza a partir del hemo y se inserta en la apoproteína C-PC mediante tres pasos enzimáticos. [21] El hemo cíclico se oxida a biliverdina IXα lineal por la hemooxigenasa y luego se convierte en 3Z-ficocianobilina, el isómero dominante de la ficocianobilina, por la 3Z-ficocianobilina:ferredoxina oxidorreductasa. La inserción de 3Z-ficocianobilina en la apoproteína C-PC a través de la formación de un enlace tioéter es catalizada por la ficocianobilina liasa. [22]
El promotor del operón cpc se encuentra en la región de 427 pb aguas arriba del gen cpcB. En A. platensis , se han identificado seis secuencias promotoras putativas en la región, cuatro de ellas mostrando expresión de proteína fluorescente verde cuando se transforman en E. coli . [23] También se ha demostrado la presencia de otros elementos positivos como elementos de respuesta a la luz en la misma región. [24]
Las múltiples secuencias promotoras y de elementos de respuesta en el operón cpc permiten que las cianobacterias y las algas rojas ajusten su expresión en respuesta a múltiples condiciones ambientales. La expresión de los genes cpcA y cpcB está regulada por la luz. Las intensidades de luz bajas estimulan la síntesis de CPC y otros pigmentos, mientras que la síntesis de pigmentos se reprime a intensidades de luz altas. [25] También se ha demostrado que la temperatura afecta la síntesis, con concentraciones de pigmentos específicos que muestran un máximo claro a 36 °C en Arthronema africanum, una cianobacteria con contenidos particularmente altos de C-PC y APC. [26]
La limitación de nitrógeno y hierro induce la degradación de ficobiliproteínas. Las fuentes de carbono orgánico estimulan la síntesis de C-PC en Anabaena spp., pero parecen no tener casi ningún efecto negativo efector en A. platensis . [27] [28] En las rodofitas Cyanidium caldarium y Galdieria sulphuraria , la producción de C-PC es reprimida por la glucosa pero estimulada por el hemo. [29]
Las extracciones de ficocianina pura se pueden aislar de las algas. El orden básico de segregación es el siguiente: la ruptura de la pared celular, con fuerzas mecánicas (congelación-descongelación) o agentes químicos (enzimas). Luego, la C-PC se aísla con centrifugación y se purifica con precipitación con sulfato de amonio o cromatografía , ya sea filtración iónica o en gel . Después, la muestra se congela y se seca . [15]
La ficocianina se puede utilizar en muchas prácticas, en particular en aplicaciones médicas y alimentarias. También se puede utilizar en genética, donde actúa como trazador debido a su fluorescencia natural. [30]
La ficocianina tiene propiedades antioxidantes y antiinflamatorias. [31] [32] [33] Los radicales peroxilo, hidroxilo y alcoxilo son oxidantes eliminados por C-PC. Sin embargo, C-PC tiene un mayor efecto sobre los radicales peroxilo. C-PC es un antioxidante que se une a los metales, ya que evita que se produzca la peroxidación lipídica. [34] Los radicales peroxilo son estabilizados por el cromóforo (una subunidad de C-PC). [35] Para eliminar los radicales hidroxilo, debe hacerse con poca luz y con altos niveles de C-PC. [36] Los radicales hidroxilo se encuentran en las partes inflamadas del cuerpo. [34] C-PC, al ser un antioxidante, elimina estos radicales que inducen daños, por lo que es un agente antiinflamatorio.
El exceso de oxígeno en el cerebro genera especies reactivas de oxígeno (ROS). Las ROS causan daño a las neuronas cerebrales, lo que lleva a una disminución de la función neurológica. La C-ficocianina elimina el peróxido de hidrógeno, un tipo de especie ROS, del interior de los astrocitos , lo que reduce el estrés oxidativo. [37] Los astrocitos también aumentan la producción de factores de crecimiento como BDNF y NDF, por lo tanto, mejoran la regeneración nerviosa. La C-PC también previene la astrogliosis y la inflamación glial. [37] [38]
Se ha descubierto que la C-ficocianina tiene protección contra la hepatotoxicidad. [31] [39] Vadiraja et al. (1998) encontraron un aumento en la transaminasa glutámico pirúvica sérica (SGPT) cuando la C-PC se trata contra heptatoxinas como el tetracloruro de carbono (CCl4) o la R-(+)-pulegona. La C-PC protege al hígado por medio del sistema del citocromo P450 . [39] Puede alterar la producción de mentofurano o alterar la formación de α, β-insaturado-γ-cetoaldehído. Ambos son componentes clave del sistema del citocromo P-450 que produce un metabolito reactivo que produce toxinas cuando se une a los tejidos del hígado. Otro posible mecanismo de protección por parte de la C-PC puede ser la eliminación de metabolitos reactivos (o radicales libres si la causa es el CCl4).
La C-ficocianina (C-PC) tiene efectos anticancerígenos. El cáncer se produce cuando las células continúan creciendo sin control. Se ha descubierto que la C-PC previene el crecimiento celular. [40] La C-PC detiene la formación de tumores antes de la fase S. La síntesis de ADN no se realiza debido a que la célula tumoral entra en G0, lo que da como resultado que no haya proliferación tumoral. [41] Además, la C-PC induce la apoptosis. Cuando las células se tratan con C-PC, se producen ROS (especies radicales de oxígeno). Estas moléculas disminuyen la producción de BCl-2 (regulador de la apoptosis). Aquí, BCl-2 inhibe proteínas llamadas caspasas. Las caspasas son parte de la vía de la apoptosis. Cuando BCl-2 disminuye, la expresión de caspasas aumenta. Como resultado, se produce la apoptosis. [42] [41] La C-PC por sí sola no es suficiente para tratar el cáncer, necesita trabajar con otros medicamentos para superar la naturaleza persistente de las células tumorales.
La C-ficocianina (C-PC) se puede utilizar como colorante alimentario azul natural. [43] Este colorante alimentario solo se puede utilizar para productos preparados a baja temperatura debido a su incapacidad para mantener su coloración azul a altas temperaturas a menos que se añadan conservantes o azúcares. [43] [44] El tipo de azúcar es irrelevante, la C-PC es estable cuando hay un alto contenido de azúcar. Sabiendo esto, la C-PC se puede utilizar para numerosos tipos de alimentos, uno de los cuales son los jarabes. La C-PC se puede utilizar para jarabes que van desde colores verdes a azules. Puede tener diferentes tintes verdes si se le añaden colorantes alimentarios amarillos.
{{cite journal}}: CS1 maint: DOI inactivo a partir de mayo de 2024 ( enlace ){{cite journal}}: CS1 maint: DOI inactivo a partir de abril de 2024 ( enlace )