Bdelloidea / ˈ d ɛ l ɔɪ d i ə / (del griego βδέλλα, bdella 'sanguijuela') es una clase de rotíferos que se encuentran en hábitats de agua dulce en todo el mundo. Hay más de 450 especies descritas de rotíferos bdelloideos (o 'bdelloides'), [1] que se distinguen entre sí principalmente por su morfología . [2] Las principales características que distinguen a los bdelloides de los grupos relacionados de rotíferos son la reproducción exclusivamente partenogenética y la capacidad de sobrevivir en ambientes secos y duros entrando en un estado de latencia inducida por desecación ( anhidrobiosis ) en cualquier etapa de la vida. [3] A menudo se los conoce como "asexuales antiguos" debido a su historia asexual única que se remonta a más de 25 millones de años a través de evidencia fósil. [4] Los rotíferos bdeloides son organismos microscópicos, que suelen tener entre 150 y 700 μm de longitud. [3] La mayoría son demasiado pequeños para ser vistos a simple vista, pero aparecen como pequeños puntos blancos incluso a través de una lupa débil , especialmente con luz brillante. En junio de 2021, los biólogos informaron sobre la recuperación de rotíferos bdeloides después de estar congelados durante 24.000 años en el permafrost siberiano . [5]
El filo Rotifera tradicionalmente incluía tres clases : Bdelloidea, Monogononta y Seisonidea . [6] Antes de 1990, los estudios filogenéticos basados en la morfología parecían indicar que el grupo hermano de los rotíferos bdelloideos era Monogononta, con los rotíferos seisónidos como un grupo externo de divergencia temprana . [7]

Los estudios filogenéticos moleculares modernos demuestran que esta comprensión clásica de 'Rotifera' es incompleta ( parafilética ), porque omite un cuarto clado de organismos estrechamente relacionados: los Acanthocephala , o gusanos de cabeza espinosa. [10] Originalmente clasificados como un filo separado , la evidencia molecular y morfológica acumulada entre 1994 y 2014 indica que Acanthocephala forma un grupo monofilético con Bdelloidea, Monogononta y Seisonidea. [8] [11] Para dar cabida a este hallazgo, algunos autores extienden el término 'Rotifera' para incluir los 'rotíferos acantocéfalos' altamente modificados y parásitos junto con los rotíferos bdelloideos, monogonontos y seisónidos. [12] Otros se refieren a la agrupación de los cuatro taxones como Syndermata, un término derivado de su epidermis sincitial compartida . [11]
La posición de Bdelloidea dentro de Syndermata (o Rotifera) no está del todo clara. Las posibles relaciones filogenéticas alternativas dentro del clado se ilustran en los cladogramas adjuntos. En 2014, el "análisis filogenómico más completo de las relaciones de los syndermatanos" hasta la fecha se basó en datos del transcriptoma de los cuatro grupos [8] y brindó un "fuerte respaldo" a la hipótesis ilustrada en la parte inferior izquierda de la figura, en la que Seisonidea y Acanthocephala son taxones hermanos. El estudio indicó además que el grupo hermano de este taxón es Bdelloidea, mientras que Monogononta es el grupo externo de los tres. Esto significaría que los parientes vivos más cercanos de los rotíferos bdelloideos no son rotíferos monógonontos, como se creía anteriormente, sino rotíferos seisónidos y acantocéfalos, a pesar de su morfología altamente modificada.
Bdelloidea es una clase del filo Rotifera , que consta de tres órdenes: Philodinavida, Philodinida y Adinetida. [13] Estos órdenes se dividen en cuatro familias y alrededor de 450 especies . [14] Dado que estos organismos son asexuales, la definición habitual de una especie como un grupo de organismos capaces de crear descendencia fértil es inaplicable, por lo tanto, el concepto de especie en estos organismos se basa en una mezcla de datos morfológicos y moleculares. Los estudios de ADN sugieren que la diversidad es mucho mayor que la que sugieren las clasificaciones morfológicas originales. [15] [16]
Los bdeloides sólo pueden identificarse a simple vista cuando están vivos, ya que muchas de las características importantes para la clasificación están relacionadas con la alimentación y el gateo; sin embargo, la identificación genética de los bdeloides es posible en individuos muertos. Una vez preservados, los individuos se contraen en "manchas" que restringen el análisis. [17] Actualmente existen tres metodologías de identificación morfológica, dos de las cuales se consideran obsoletas: Bartoš (1951) [18] y Donner (1965). [14] El tercer método es una clave diagnóstica desarrollada en 1995 por Shiel. [17]
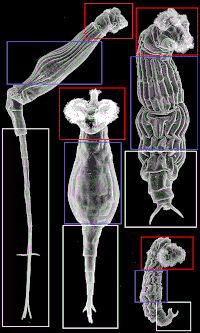
Existen tres regiones principales en el cuerpo de los bdeloides: cabeza, tronco y pie. La imagen adyacente muestra cada área para mostrar cómo las partes del cuerpo pueden ser muy diferentes, aunque se les dé el mismo nombre según la especie de que se trate. Los bdeloides suelen tener una corona bien desarrollada, dividida en dos partes, sobre una cabeza retráctil.
Algunas características identificables de los bdelloides incluyen:
Los sistemas digestivo y reproductivo de los bdeloides se encuentran en las secciones del tronco de sus cuerpos, siendo el estómago el órgano más visible . En ciertos géneros ( Habrotrocha , Otostefanos y Scepanotrocha ), los bdeloides se pueden identificar por la aparición de bolitas esféricas distintivas dentro del estómago, que se liberan en forma de heces. Estas bolitas son una característica distintiva, ya que todos los demás géneros liberan heces como material suelto. [3]
La mayoría de los bdeloides retraen el pie mientras comen, pero hay cuatro géneros que carecen de pie: Adineta , Bradyscela , Henoceros y Philodinavus . Esto afecta no solo a la forma en que se alimentan, sino también a la forma en que se arrastran; por ejemplo, Adineta y Bradyscela se deslizan mientras que los otros géneros giran. [3]
El comportamiento de los bdelloideos se puede dividir en cuatro categorías: alimentación, locomoción, reproducción y comportamientos inducidos por estrés.
El comportamiento alimentario específico de los bdeloides es variado, pero la mayoría utiliza anillos de cilios en el órgano de la corona para crear corrientes de agua que soplan el alimento a través de la boca hasta el órgano mástax que ha sido adaptado específicamente para moler alimentos. [19] El alimento incluye bacterias suspendidas, algas, detritos y otras cosas.
Parece haber tres métodos principales de movimiento: natación libre , avance lento a lo largo de un sustrato o sesilidad . El avance lento (o gateo) implica dar pasos alternos con la cabeza y la cola, como hacen ciertas sanguijuelas , lo que le da al grupo su nombre ( griego βδέλλα o bdella , que significa sanguijuela). Este video demuestra cómo se mueven los bdelloides en tres situaciones diferentes: locomoción y alimentación de rotíferos bdelloides.
Los bdeloides son de interés en el estudio de la evolución del sexo porque nunca se ha observado un macho, [20] y las hembras se reproducen exclusivamente por partenogénesis [ ancla rota ] , una forma de reproducción asexual donde los embriones crecen y se desarrollan sin necesidad de fertilización; esto es similar a la apomixis que se ve en algunas plantas. [21] Cada individuo tiene gónadas pareadas . A pesar de haber sido asexuales durante millones de años, se han diversificado en más de 450 especies y son bastante similares a otras especies de rotíferos que se reproducen sexualmente.
Sin embargo, un nuevo estudio proporcionó evidencia de intercambio genético interindividual y recombinación en Adineta vaga , una especie que anteriormente se creía que era antiguamente asexual. [22]
Adineta vaga es capaz de llevar a cabo la reparación del ADN mediante una meiosis no reductiva . [23] La reparación del ADN de la línea germinal ocurre en un período específico de la ovogénesis durante el cual los cromosomas homólogos adoptan una configuración yuxtapuesta similar a la meiótica. [23] Esta reparación del ADN de la línea germinal da como resultado una reconstitución precisa del material genético transmitido a la descendencia.
En 2003, el modo de reproducción asexual en los rotíferos bdeloides era totalmente desconocido. [24] Una teoría de cómo surgió la partenogénesis obligada en los rotíferos bdeloides era que los linajes partenogénicos perdieron la capacidad de responder a la señal inductora del sexo, por lo que estos linajes conservaron su asexualidad. [25] Las cepas partenogenéticas obligadas de rotíferos bdeloides producen una señal inductora del sexo, pero han perdido la capacidad de responder a esa señal. Más tarde se descubrió que la incapacidad de responder a las señales inductoras del sexo en los partenógenos obligados se debía a una simple herencia mendeliana del gen op. [26]
Los bdeloides son capaces de sobrevivir a las tensiones ambientales entrando en un estado de latencia conocido como anhidrobiosis que permite al organismo deshidratarse rápidamente y, por lo tanto, resistir la desecación. Mientras se preparan para este estado latente, muchos procesos metabólicos se ajustan para compensar el cambio de estado; por ejemplo, la producción de sustancias químicas protectoras. [27] El bdeloides puede permanecer en este estado, que se conoce como "xerosoma", hasta que regrese una cantidad suficiente de agua, momento en el que se rehidratará y se activará en cuestión de horas. La eclosión de las crías solo ocurrirá cuando las condiciones sean más favorables. [28] Estas formas de latencia también se conocen como criptobiosis o quiescencia. Se sabe que los bdeloides sobreviven en este estado hasta 9 años mientras esperan que regresen las condiciones favorables. [28] Además de sobrevivir a la desecación a través de la anhidrobiosis, el estrés por desecación en dos especies de bdeloides en realidad ayudó a mantener la aptitud e incluso mejoró la fecundidad de su especie . [29] Los rotíferos que se mantuvieron hidratados de forma constante tuvieron peores resultados que los que fueron desecados y rehidratados. [30]
Los bdelloidea han desarrollado un mecanismo único para ayudar a superar uno de los principales peligros de la reproducción asexual. Según la hipótesis de la Reina Roja de la coevolución , los asexuales obligados se extinguirán a causa de los parásitos y patógenos que cambian rápidamente, porque no pueden cambiar sus genotipos lo suficientemente rápido como para seguir el ritmo de esta carrera sin fin. Sin embargo, en las poblaciones de rotíferos bdelloideos, muchos parásitos son destruidos durante períodos de desecación prolongada. [31] Además, los rotíferos bdelloideos desecados son fácilmente arrastrados por el viento fuera de los hábitats infestados de parásitos y establecen poblaciones nuevas y saludables en otros lugares, lo que les permite escapar de la Reina Roja moviéndose en el tiempo y el espacio en lugar de usar el sexo para cambiar su genotipo. [32]
Cuando estas criaturas se recuperan de la desecación, se ha demostrado que experimentan un proceso genético potencialmente único en el que se produce una transferencia horizontal de genes [ cita requerida ] , lo que da como resultado que una proporción significativa del genoma bdelloideo, hasta el 10%, se haya obtenido mediante transferencia horizontal de genes de bacterias, hongos y plantas. [33] Cómo y por qué se produce la transferencia horizontal de genes en los bdelloideos es objeto de mucho debate en la actualidad; particularmente con respecto a las posibles conexiones entre los genes extraños y el proceso de desecación, así como las posibles conexiones con la antigua asexualidad de los bdelloideos.
Cuando se secan por completo, su ADN se desintegra en muchos fragmentos. Y cuando vuelven a la vida después de ser rehidratados, esto crea una oportunidad para que fragmentos de ADN extraños entren en su genoma. Este proceso se mejoró hace 60 millones de años cuando capturaron un gen bacteriano de esta manera, lo que les proporcionó un nuevo sistema de regulación genética. El nuevo sistema se utilizó para mantener los transposones bajo control. [34]
Los rotíferos Bdelloideos son extraordinariamente resistentes al daño de la radiación ionizante debido a las mismas adaptaciones de preservación del ADN utilizadas para sobrevivir a la latencia. [35] Estas adaptaciones incluyen un mecanismo extremadamente eficiente para reparar roturas de doble cadena de ADN. [36] Este mecanismo de reparación se estudió en dos especies de Bdelloidea, Adineta vaga , [36] y Philodina roseola . [37] y parece involucrar recombinación mitótica entre regiones de ADN homólogas dentro de cada especie.
Se ha documentado la transferencia horizontal a gran escala de genes bacterianos, vegetales y fúngicos a rotíferos bdelloides [38] , y puede representar un factor importante en la evolución de los bdelloides.