Las alfa secretasas son una familia de enzimas proteolíticas que escinden la proteína precursora amiloide (APP) en su región transmembrana . Específicamente, las alfa secretasas escinden dentro del fragmento que da lugar al péptido beta amiloide asociado a la enfermedad de Alzheimer cuando la APP es procesada por beta secretasa y gamma secretasa . La vía de la alfa-secretasa es la vía de procesamiento predominante de la APP. Por lo tanto, la escisión de la alfa-secretasa impide la formación de beta amiloide y se considera parte de la vía no amiloidogénica en el procesamiento de la APP. Las alfa secretasas son miembros de la familia ADAM ('un dominio de desintegrina y metaloproteasa '), que se expresan en las superficies de las células y se anclan en la membrana celular . Varias de estas proteínas, en particular ADAM10 , se han identificado como poseedoras de actividad alfa-secretasa. Tras la escisión por alfa secretasas, la APP libera su dominio extracelular (un fragmento conocido como APPsα) en el entorno extracelular en un proceso conocido como desprendimiento de ectodominio . [1]
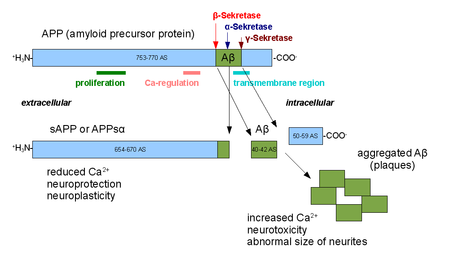
ADAM10 consta de dos dominios proteicos , un dominio de desintegrina y un prodominio; sin embargo, solo el prodominio es necesario para el procesamiento de APP. [2] Otras proteínas ADAM, ADAM17 (también llamada TACE, enzima convertidora del factor de necrosis tumoral-α ), [3] ADAM9 , [4] y ADAM19 [5] también se han identificado como alfa secretasas; la expresión extracelular de ADAM9 mutante (también conocida como MDC9 o meltrina gamma) que carece del dominio de anclaje a la membrana se ha sugerido como uno de los muchos medios posibles de prevención y tratamiento del Alzheimer explotando la vía de la alfa secretasa. [6] Se han observado dos modalidades distintas de actividad de la alfa-secretasa en las células; la actividad constitutiva ocurre principalmente en la superficie celular [ cita requerida ] y es independiente de los mecanismos reguladores dentro de la célula, mientras que la actividad regulada ocurre principalmente en el aparato de Golgi y depende de la actividad de la proteína quinasa C. Se cree que la actividad de la alfa-secretasa en el aparato de Golgi compite directamente con la vía de la beta-secretasa por los sustratos de la APP durante la maduración de las proteínas de membrana. [7] La escisión de la superficie celular por la alfa-secretasa es muy rápida después de que la APP alcanza la superficie celular. [8]
La actividad de las alfa secretasas se ha visto implicada en la regulación del aprendizaje y la formación de la memoria . La liberación del ectodominio APPsα tiene efectos neurotróficos que contrarrestan la señalización apoptótica y promueven la formación de sinapsis , procesos que se regulan positivamente cuando se sobreexpresa ADAM10. [9] También se ha observado que la actividad de la alfa secretasa se regula positivamente en respuesta al péptido de señalización PACAP . [10]
Las alfa-secretasas relacionadas, incluida la ADAM10, también han sido implicadas en eventos de maduración similares para otras proteínas transmembrana como las proteínas MHC de clase I. Evidencias recientes sugieren que algunas de estas proteínas son procesadas primero a ectodominios por alfa secretasas y posteriormente escindidas por otro complejo de proteasas asociado con el Alzheimer , la gamma secretasa en su forma complejada con presenilina . [11] La vía Notch tiene muchas similitudes con el procesamiento de APP y también está regulada en parte por ADAM10. [12]