
En química orgánica , un grupo alilo es un sustituyente con la fórmula estructural −CH 2 −HC=CH 2 . Consiste en un puente de metileno ( −CH 2 − ) unido a un grupo vinilo ( −CH=CH 2 ). [1] [2] El nombre se deriva del nombre científico del ajo , Allium sativum . En 1844, Theodor Wertheim aisló un derivado alílico del aceite de ajo y lo llamó " Schwefelallyl ". [3] [4] El término alilo se aplica a muchos compuestos relacionados con H 2 C=CH−CH 2 , algunos de los cuales son de importancia práctica o cotidiana, por ejemplo, el cloruro de alilo .
La alilación es cualquier reacción química que agrega un grupo alilo a un sustrato . [1]

Un sitio adyacente al átomo de carbono insaturado se llama posición alílica o sitio alílico . Un grupo adherido a este sitio a veces se describe como alílico . Así, CH 2 =CHCH 2 OH "tiene un grupo hidroxilo alílico ". Los enlaces alílicos C-H son aproximadamente un 15% más débiles que los enlaces C-H en los centros de carbono sp 3 ordinarios y, por tanto, son más reactivos.
El bencílico y el alílico están relacionados en términos de estructura, fuerza de unión y reactividad. Otras reacciones que tienden a ocurrir con los compuestos alílicos son las oxidaciones alílicas , las reacciones eno y la reacción de Tsuji-Trost . Los grupos bencílicos están relacionados con los grupos alilo; ambos muestran una reactividad mejorada.
Un grupo CH 2 conectado a dos grupos vinilo se dice que es doblemente alílico . La energía de disociación de los enlaces C-H en un centro doblemente alílico es aproximadamente un 10% menor que la energía de disociación de un enlace C-H que es simplemente alílico. Los enlaces C-H debilitados se reflejan en la fácil oxidación de compuestos que contienen enlaces 1,4- pentadieno ( C=C-CH2 - C=C ). Algunos ácidos grasos poliinsaturados presentan este grupo pentadieno: ácido linoleico , ácido α-linolénico y ácido araquidónico . Son susceptibles a una variedad de reacciones con el oxígeno (O 2 ), comenzando con la peroxidación lipídica . Los productos incluyen hidroperóxidos de ácidos grasos , ácidos grasos poliinsaturados epoxi-hidroxi, jasmonatos , ácidos grasos de éter divinílico y aldehídos de hojas . Algunos de estos derivados son moléculas de señalización, algunos se utilizan en la defensa de las plantas ( antialimentarios ), algunos son precursores de otros metabolitos que utiliza la planta. [5]
Una consecuencia práctica de su alta reactividad es que los ácidos grasos poliinsaturados tienen una vida útil corta debido a su tendencia a la autooxidación , lo que lleva, en el caso de los comestibles, a la rancidificación . Los metales aceleran la degradación. Estas grasas tienden a polimerizarse formando semisólidos. Este patrón de reactividad es fundamental para el comportamiento filmógeno de los " aceites secantes ", que son componentes de las pinturas y barnices al óleo .
El término homoalílico se refiere a la posición en un esqueleto de carbono junto a una posición alílica. En el cloruro de but-3-enilo CH 2 =CHCH 2 CH 2 Cl , el cloruro es homoalílico porque está unido al sitio homoalílico.

El grupo alilo se encuentra ampliamente en la química orgánica. [1] Los radicales alílicos , aniones y cationes a menudo se analizan como intermediarios en las reacciones . Todos cuentan con tres centros de carbono con hibridación sp² contiguos y todos obtienen estabilidad de la resonancia. [6] Cada especie puede presentarse mediante dos estructuras de resonancia con la carga o el electrón desapareado distribuido en ambas posiciones 1,3.

En términos de la teoría MO , el diagrama MO tiene tres orbitales moleculares: el primero enlazante, el segundo no enlazante y el orbital de mayor energía es antienlazante. [2]

[8]
Esta mayor reactividad de los grupos alílicos tiene muchas consecuencias prácticas. La vulcanización con azufre o diversos cauchos aprovecha la conversión de grupos CH2 alílicos en enlaces cruzados CH-S x -CH . De manera similar, los aceites secantes como el aceite de linaza se reticulan mediante la oxigenación de sitios alílicos (o doblemente alílicos). Esta reticulación sustenta las propiedades de las pinturas y el deterioro de los alimentos por rancidificación .
La producción industrial de acrilonitrilo mediante amoxidación de propeno aprovecha la fácil oxidación de los centros alílicos C-H:
Se estima que la cloración del propileno produce unas 800.000 toneladas (1997) de cloruro de alilo :
Es el precursor del alcohol alílico y de la epiclorhidrina .
La alilación es la unión de un grupo alilo a un sustrato, generalmente otro compuesto orgánico. Clásicamente, la alilación implica la reacción de un carbanión con cloruro de alilo. Las alternativas incluyen la alilación de carbonilo con reactivos alilmetálicos, como aliltrimetilsilano , [9] [10] [11] o la alilación de Krische catalizada por iridio .
La alilación también puede efectuarse mediante la adición de conjugados : la adición de un grupo alilo a la posición beta de una enona . La reacción de Hosomi-Sakurai es un método común para la alilación conjugada. [12]
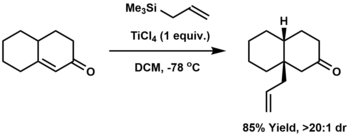
Los enlaces CH alílicos son susceptibles a la oxidación. [13] Una aplicación comercial de la oxidación alílica es la síntesis de nootkatona , la fragancia del pomelo , a partir de valenceno , un sesquiterpenoide disponible en mayor abundancia : [14]

En la síntesis de algunas sustancias químicas finas, el dióxido de selenio se utiliza para convertir alquenos en alcoholes alílicos: [15]
donde R, R', R'' pueden ser sustituyentes alquilo o arilo .
Desde el punto de vista industrial, la oxidación de enlaces CH bencílicos se lleva a cabo a gran escala, por ejemplo, en la producción de ácido tereftálico , ácido benzoico e hidroperóxido de cumeno . [dieciséis]
Se pueden unir muchos sustituyentes al grupo alilo para dar compuestos estables. Los compuestos alílicos comercialmente importantes incluyen: