
En química analítica , un agente derivatizante quiral ( CDA ), también conocido como reactivo de resolución quiral , es un reactivo de derivatización que es un auxiliar quiral utilizado para convertir una mezcla de enantiómeros en diastereómeros con el fin de analizar las cantidades de cada enantiómero presente y determinar la pureza óptica de una muestra. El análisis se puede realizar mediante espectroscopia o cromatografía. Algunas técnicas analíticas como HPLC y RMN , en sus formas más comunes, no pueden distinguir enantiómeros dentro de una muestra, pero pueden distinguir diastereómeros. Por lo tanto, la conversión de una mezcla de enantiómeros en una mezcla correspondiente de diastereómeros puede permitir el análisis. El uso de agentes derivatizantes quirales ha disminuido con la popularización de la HPLC quiral . Además del análisis, la derivatización quiral también se utiliza para la resolución quiral , la separación física real de los enantiómeros.
Desde que la espectroscopia de RMN ha estado disponible para los químicos, ha habido numerosos estudios sobre las aplicaciones de esta técnica. Uno de ellos observó la diferencia en el desplazamiento químico (es decir, la distancia entre los picos) de dos diastereómeros. [1] Por el contrario, dos compuestos que son enantiómeros tienen las mismas propiedades espectrales de RMN. Se razonó que si una mezcla de enantiómeros pudiera convertirse en una mezcla de diastereómeros uniéndolos a otra sustancia química que fuera quiral, sería posible distinguir esta nueva mezcla utilizando RMN y, por lo tanto, aprender sobre la mezcla enantiomérica original. El primer ejemplo popular de esta técnica fue publicado en 1969 por Harry S. Mosher . El agente quiral utilizado fue un solo enantiómero de MTPA (ácido α-metoxi-α-(trifluorometil)fenilacético), también conocido como ácido de Mosher . [2] El cloruro de ácido correspondiente también se conoce como cloruro de ácido de Mosher y los ésteres diastereoméricos resultantes se conocen como ésteres de Mosher. Otro sistema es el alcohol de Pirkle desarrollado en 1977.
El uso general y el diseño de los CDA obedecen a las siguientes reglas para que el CDA pueda determinar eficazmente la estereoquímica de un analito: [3]
El ácido de Mosher , a través de su derivado cloruro de ácido, reacciona fácilmente con alcoholes y aminas para dar ésteres y amidas, respectivamente. La falta de un protón alfa en el ácido evita la pérdida de fidelidad estereoquímica en las condiciones de reacción. Por lo tanto, el uso de un ácido de Mosher enantioméricamente puro permite la determinación de la configuración de aminas y alcoholes quirales simples . [4] Por ejemplo, los enantiómeros ( R ) y ( S ) del 1-feniletanol reaccionan con el cloruro de ácido de Mosher ( S ) para producir diastereómeros ( R , S ) y ( S , S ), respectivamente, que son distinguibles en RMN. [5]
Un nuevo agente derivatizante quiral (CDA), el ácido α-ciano-α-fluoro (2-naftil)-acético (2-CFNA), se preparó en forma ópticamente pura mediante la separación por HPLC quiral de un éster metílico de 2-CFNA racémico. Este éster se obtuvo mediante fluoración de acetato de metilo α-ciano (2-naftil) con FClO3. Se ha demostrado que el 2-CFNA es un CDA superior al agente de Mosher para determinar el exceso enantiomérico de un alcohol primario. [6]
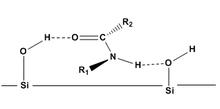
Tras la reacción de un CDA con el analito de interés, se puede utilizar la cromatografía para separar los productos resultantes. En general, la cromatografía se puede utilizar para separar compuestos quirales para evitar cristalizaciones difíciles y/o para recoger todos los pares de diastereómeros en solución. La cromatografía también tiene muchas variaciones (por ejemplo , HPLC , cromatografía de gases , cromatografía flash ) con una amplia gama de aplicabilidad a diversas categorías de moléculas. La capacidad de los CDA para separar moléculas quirales depende de dos mecanismos principales de la cromatografía: [7]
Los postulados de Helmchen [8] [9] son los modelos teóricos que se utilizan para predecir el orden de elución y el grado de separación de los diastereómeros (incluidos los formados a partir de los CDA) que se adsorben sobre una superficie. Aunque los postulados de Helmchen son específicos para las amidas en gel de sílice mediante cromatografía líquida, proporcionan pautas fundamentales para otras moléculas. Los postulados de Helmchen son:
Se ha demostrado que los postulados de Helmchen son aplicables a otros grupos funcionales como: carbamatos , [7] ésteres , [10] y epóxidos . [11]
Las fases estacionarias pueden reaccionar con CDA para formar fases estacionarias quirales que pueden resolver moléculas quirales. [12] Al reaccionar con alcoholes en una fase estacionaria de silicato, los CDA agregan un centro quiral a la fase estacionaria, lo que permite la separación de moléculas quirales.
Los CDA se utilizan con el análisis espectroscópico de RMN para determinar el exceso enantiomérico y la configuración absoluta de un sustrato. Los agentes discriminantes quirales a veces son difíciles de distinguir de los agentes solvatantes quirales (CSA) y algunos agentes pueden usarse como ambos. La velocidad del intercambio entre el sustrato y el centro metálico es el factor determinante más importante para diferenciar entre el uso de un compuesto como CDA o CSA. Generalmente, un CDA tiene un intercambio lento mientras que un CSA tiene un intercambio rápido. [13] Los CDA se usan más ampliamente que los CSA para determinar configuraciones absolutas porque el enlace covalente al sustrato y al reactivo auxiliar produce especies con mayor rigidez conformacional que crea mayores diferencias en los espectros de RMN. [14] Los CDA y los CSA se pueden usar juntos para mejorar el reconocimiento quiral, aunque esto no es común.
Los reactivos de desplazamiento de RMN como EuFOD , alcohol de Pirkle y TRISPHAT aprovechan la formación de complejos diastereoméricos entre el reactivo de desplazamiento y la muestra analítica. [15]
Las principales preocupaciones a tener en cuenta al utilizar un CDA en espectroscopia de RMN son la resolución cinética , la racemización durante la reacción de derivatización y que el reactivo debe tener una pureza óptica del 100%. La resolución cinética es especialmente significativa al determinar la pureza óptica, pero es algo insignificante cuando se utiliza el CDA para asignar la configuración absoluta de un sustrato ópticamente puro. [13] La resolución cinética se puede superar utilizando un exceso de CDA. [16] La racemización puede ocurrir tanto en el CDA como en el sustrato y en ambos casos tiene el potencial de afectar significativamente los resultados.
Los dos métodos básicos de análisis de RMN son la derivatización simple y la derivatización doble. La derivatización doble generalmente se considera más precisa, pero la derivatización simple generalmente requiere menos reactivos y, por lo tanto, es más rentable.
El espectro de RMN del producto formado a partir de la reacción del sustrato con un CDA a temperatura ambiente se compara con uno de los siguientes: [14]
O bien el enantiómero del sustrato se derivatiza con dos enantiómeros del CDA o bien ambos enantiómeros del sustrato se derivatizan con un enantiómero del CDA. En ambos casos se forman dos diastereómeros y se evalúan los desplazamientos químicos de sus núcleos para asignar la configuración del sustrato. [16]
Las técnicas de RMN más comunes que se utilizan para discriminar compuestos quirales son 1 H-NMR, 19 F-NMR y 13 C-NMR. 1 H-NMR es la técnica principal utilizada para asignar la configuración absoluta. 19 F-NMR se aplica casi exclusivamente a estudios de pureza óptica, y 13 C-NMR se utiliza principalmente para caracterizar sustratos que no tienen protones que estén directamente unidos a un átomo de carbono asimétrico. [14]